【2015广东理综化学】下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
分别加热Na2CO3和NaHCO3固体 |
试管内壁都有水珠 |
两种物质均受热分解 |
| B |
向稀的苯酚水溶液中滴加饱和溴水 |
生成白色沉淀 |
产物三溴苯酚不溶于水 |
| C |
向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 |
加入淀粉后溶液变成蓝色 |
氧化性:Cl2>I2 |
| D |
向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 |
加入H2O2后溶液变成血红色 |
Fe2+既有氧化性又有还原性 |
根据原子序数推断,下列各组元素化合时能以离子键结合的是()
| A.10与19 | B.6与16 | C.14与8 | D.11与17 |
下列不属于铵盐的共同性质的是( )
| A.易溶于水 | B.与苛性钠共热产生NH3 |
| C.都是晶体 | D.受热分解都产生NH3 |
常温下,将一小块铝片投入足量的下列溶液中,铝片可以溶解但无氢气产生的是()。
| A.浓盐酸 | B.稀硝酸 | C.氢氧化钠溶液 | D.浓硝酸 |
用惰性电极电解物质的量浓度均为0.2 mol/L NaCl和CuSO4的混合液200 mL,经一段时间后,阴极上得到896 mL (标准状况下)的气体,则阳极收集到气体的体积为(标准状况、不考虑气体的溶解)
| A.672 mL | B.896 mL | C.1120 mL | D.1344mL |
一定温度下,在一个固定容积的密闭容器里发生N2(g)+3H2(g)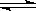 2NH3(g) 反应,此反应达到化学平衡状态的标志是:①N2,H2和NH3的质量分数不再改变,②容器内的压强不随时间的变化而变化,③c(N2)∶c(H2)∶c(NH3)=1∶3∶2 ,④单位时间里每增加1molN2,同时增加3molH2,⑤一段时间内N2:H2:NH3的平均化学反应速率之比为1:3:2 ,⑥容器中气体的密度不变
2NH3(g) 反应,此反应达到化学平衡状态的标志是:①N2,H2和NH3的质量分数不再改变,②容器内的压强不随时间的变化而变化,③c(N2)∶c(H2)∶c(NH3)=1∶3∶2 ,④单位时间里每增加1molN2,同时增加3molH2,⑤一段时间内N2:H2:NH3的平均化学反应速率之比为1:3:2 ,⑥容器中气体的密度不变
| A.①②③④⑤⑥ | B.①②⑤⑥ | C.①②⑥ | D.只有①② |