【2015海南化学】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:
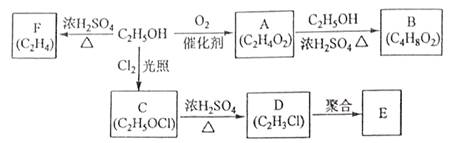
回答下列问题:
(1)A的结构简式为 。
(2)B的化学名称是 。
(3)由乙醇生产C的化学反应类型为 。
(4)E是一种常见的塑料,其化学名称是 。
(5)由乙醇生成F的化学方程式为 。
存在于茶叶中的芳香族化合物A,其氧元素的质量分数为29.27%,相对分子质量不超过170,苯环上的一氯代物有两种。1mol A分别与足量的NaHCO3溶液和NaOH溶液反应,消耗的两种物质的物质的量之比为1:2。
(1)写出下列物质的结构简式:
CD
(2)A中含氧官能团的名称是
B物质不能发生的反应类型有(填选项)
①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤还原反应 ⑥水解反应 ⑦酯化反应
(3)写出下列反应的化学方程式:
A→E:
F→G:
(4)芳香醇R的所有含有苯环的同分异构体(不包括R)有种。
某化学小组采用如图装置,以冰醋酸和异戊醇制备少量乙酸异戊酯(俗称:香蕉水)。
已知:CH3COOH+HOCH2CH2CH(CH3)2 CH3COOCH2CH2CH(CH3)2+H2O
CH3COOCH2CH2CH(CH3)2+H2O
密度(g/m L) L) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 冰醋酸 |
1.049 |
16.6 |
118.1 |
能溶于水 |
| 异戊醇 |
0.812 |
-117.2℃ |
130.5 |
微溶于水 |
| 乙酸异戊酯 |
0.869 |
-78℃ |
140 |
难溶于水 |
实验步骤:
(1)制备粗品
在50mL干燥的中(填仪器名称)加入10mL(8.1g , 0.092mol)异戊醇和10mL(10.5g , 0.175mol)冰醋酸,振摇下缓缓加入2.5mL浓硫酸并使其混合均匀,再投入几块碎瓷片,装上冷凝管,冷却水从_________口进入,控制温度100℃左右,加热回流至锥形瓶中液体无明显增加为止。
A中碎瓷片的作用是
锥形瓶中的液体主要是,采用边反应边将其蒸出的方法的目的是。
(2)制备精品
①反应结束后,冷却反应物至室温。将装置A中的反应混合物倒入分液漏斗中,用少量饱和食盐水荡洗反应瓶,一起并入分液漏斗。用饱和食盐水代替蒸馏水的优点是。
②振摇分液漏斗,静置分层后分去水层。有机层先用25 mL 10% 碳酸钠水溶液洗涤除去杂质 ,再用水洗涤两次。分尽水层后将酯层转入干燥的锥形瓶中,用(填写选项)干燥0.5h。
a.五氧化二磷 b.碱石灰 c.无水硫酸镁 d.生石灰
③将干燥后的液体过滤到装置A中,加热蒸馏收集℃的馏分,称重,产物重8.4g,则该实验的产率为。(保留两位有效数字)
 是周期表中原子序数依次增大的前20号元素。
是周期表中原子序数依次增大的前20号元素。 同周期。
同周期。 同主族,Zn-与
同主族,Zn-与 离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下
离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下 为液体,
为液体, 为气态化合物,且
为气态化合物,且 均为直线型分子;
均为直线型分子; 是由元素
是由元素 形成的常见化合物。
形成的常见化合物。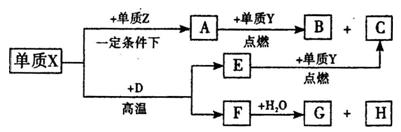
(1)元素 的名称,
的名称, 的电子式,F晶体中含有的化学键类型。
的电子式,F晶体中含有的化学键类型。
(2)写出 的化学式:
的化学式: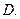 、
、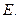 。
。
(3)①已知38g 与单质
与单质 完全反应生成
完全反应生成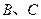 时放出
时放出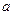 kJ的热量,写出该反应的热化学方程式:
kJ的热量,写出该反应的热化学方程式:
②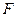 与水反应的化学方程式:
与水反应的化学方程式:
已知甲、乙、丙、丁、戊为纯净物,它们之间有如下转化关系。请填空:
(1)若甲为厨房中常见的调味品,在熔融条件下电解能实现上述转化。以惰性电极电解甲的水溶液时,电解反应的离子方程式为:。
(2)若甲为常见的离子化合物,可用作化肥,在加热条件下能实现上述转化。则反应②的化学反应方程式:。实验室测定丁的相对分子质量时,得到的实验值总是比理论值大,其原因是。(用方程式表示)
(3)若甲为制镜工业的常用物质,相对分子质量是甲醛的6倍,在催化剂存在条件下能实现上述转化。则反应①的化学反应方程式为:;以 乙物质为燃料的微生物燃料电池结构示意图如图所示,该原电[来池的负极反应方程式为
乙物质为燃料的微生物燃料电池结构示意图如图所示,该原电[来池的负极反应方程式为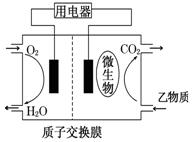
(6分)利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池。
(1)画出装置图(在图中标出电极材料、正负极、电解质溶液)。
(2)写出电极反应方程式
负极 :
:
正极:(各2分)