【2015海南化学】[选修3—物质结构与性质]
I、下列物质的结构或性质与氢键无关的是 。
| A.乙醚的沸点 | B.乙醇在水中的溶解度 |
| C.氢化镁的晶格能 | D.DNA的双螺旋结构 |
II、钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。
回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长由两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个σ键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
(1)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。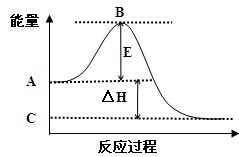 请回答下列问题:
请回答下列问题: ①图中A点表示:
①图中A点表示:
C点表示:
E的大小对该反应的反应热 (填“有”或“无”)影响。 ②图中△H= kJ/mol。
②图中△H= kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
(1)除去混入Fe2O3粉末中少量Al2O3杂质的试剂是 ,
离子方程式为 。
(2)除去NaCO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。
(3)用离子方程式表示怎样用化学方法除去下列物质中混有的少量杂质:
①铁粉中混有铝粉
②FeCl2溶液中混有FeCl3
③FeCl3溶液中混有FeCl2
(4)通常用 试剂除去CO2中的HCl气体,反应的离子方程式为 。
如何除去杂质,提纯下列各物质
| 混合物成分 |
提纯所用试剂的化学式 |
| (1)MgO中混有少量Al2O3杂质 |
|
| (2)FeCl2溶液中混少量FeCl3 |
|
| (3)FeCl3溶液中混少量FeCl2 |
|
| (4)FeSO4溶液中混少量CuSO4 |
|
| (5)NaCl溶液中混有少量NaBr |
有下列物质:①二氧化碳②硝酸钾晶体③液氯④氢气⑤氯水⑥石墨⑦氢氧化钠固体⑧稀硫酸⑨熔融氯化钠⑩铝。请用序号回答下列问题:
(1)属于混合物的是__________;属于非金属单质的是__________。
(2)属于电解质的是__________;能够导电的是__________。
(3)能与稀盐酸发生氧化还原反应的是__________;该反应的离子方程式为:__________。
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质,并用来生产ZnSO4 ·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的 pH 如下表。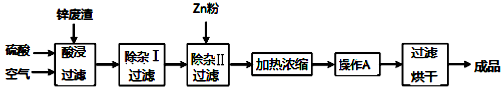
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Cu(OH)2 |
| 开始沉淀的 pH |
3.3 |
1.5 |
6.5 |
5.4 |
4.2 |
| 沉淀完全的 pH |
5.2 |
3.7 |
9.7 |
8.0 |
6.7 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有____________。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是______________。为使 Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为__________________。为控制上述pH范围可选择加入的试剂或药品是 。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)常温下,已知 Ksp[Zn(OH)2]=5×10-17,某 ZnSO4溶液里c(Zn2+)=0.5mol/L,如果要生成Zn(OH)2沉淀,则应调整溶液 pH 大于_______________。
(4)当向含相同浓度Cu2+、Fe3+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]________Ksp[Cu(OH)2](填“>”、“=”或“<”)