在实验室中,小明同学为了探究金属与盐溶液的反应规律,将一定质量的某种金属M的粉末放入AgNO3与Cu(NO3)2的混合溶液中,实验过程及现象如图所示,结合实际现象判断,小明同学得出的以下结论中,错误的是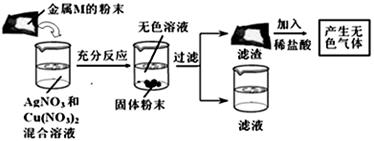
| A.滤液中一定没有银离子 | B.滤渣中一定含有金属单质M |
| C.滤渣中一定含有单质铜 | D.加入的金属M可能是单质铁 |
由乙烯推测丙烯的结构或性质,正确的是 ()
()
| A.分子中三个碳原子在同一直线上 |
| B.分子中所有原子在同一平面上 |
| C.与HCl加成只生成一种产物 |
| D.在一定条件下,能发生加聚反应 |
下列化学用语的书写正确的是()
| A.乙酸的分子式:C2H4O2 | B.乙醇的结构简式:C2H6O |
C.F原子结构示意图: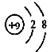 |
D.四氯化碳的电子式: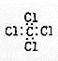 |
下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是()
| A.金属钠 | B.水 |
| C.碳酸钠溶液 | D.无色的酚酞试液 |
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是()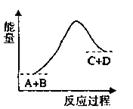
| A.该反应为放热反应 |
| B.该反应为吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应只有在加热条件下才能进行 |
下列说法错误的是 ()
()
①化学性质相似的有机物是同系物
②分子组成相差一个或n个“CH2”原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
| A.①②③④ | B.只有②③ | C.只有③④ | D.只有①②③ |