X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
| A.由mXa+与nYb-,得m+a=n-b |
| B.X2-的还原性一定大于Y- |
| C.X,Y一定不同周期 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY |
设NA为阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,22.4 L甲苯中含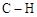 键数目为8 NA 键数目为8 NA |
| B.常温常压下,7.8 g苯中含有双键的数目为0.3 NA |
| C.苯和苯甲酸的混合物1 mol,完全燃烧消耗O2的分子数为7.5 NA |
| D.常温常压下,5.2 g苯和苯乙烯的混合物中含有原子数目为0.8 NA |
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为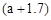 g。下列说法不正确的是
g。下列说法不正确的是
A.镁铝合金与盐酸反应转移电子总数为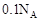 |
B.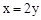 |
C.沉淀是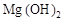 和 和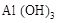 的混合物 的混合物 |
| D.1.2>a>0.9 |
恒温下使某盐溶液蒸发掉ag水,有bg不含结晶水的晶体析出,再蒸发掉ag水后,又有cg不含结晶水的晶体析出,则原溶液中溶质的质量分数为
A. |
B.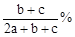 |
C.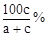 |
D.无法确定 |
下列实验中,依据实验操作及现象,得出的结论正确的是
| 操作 |
现 象 |
结 论 |
|
| A. |
测定等浓度的Na2CO3和Na2SO3 溶液的pH |
前者pH比后者的大 |
非金属性: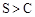 |
| B. |
无色溶液中滴加氯水和CCl4, 振荡、静置 |
下层溶液显紫色 |
原溶液中有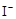 |
| C. |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有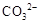 或  |
| D. |
向某无色溶液中滴加硝酸酸化的BaCl2溶液 |
产生白色沉淀 |
溶液中一定含有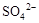 |
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g) 2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
A.当容器内密度保持不变时,可以判断反应已达平衡
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353