2SO2 (g)+O2(g) 2SO3(g)是制备硫酸的重要反应之一。下列叙述正确的是
2SO3(g)是制备硫酸的重要反应之一。下列叙述正确的是
| A.催化剂V2O5,不改变该反应的逆反应速率 |
| B.将2 mol SO2与2 mol O2放人密闭容器中,最终生成2mol SO3 |
| C.在t1、t2时刻,SO2 (g)的浓度分别是C1、C2,则时间间隔t1-t2内,SO2(g)消耗的平均速率为V=(c1-c2)÷(t2-t1) |
| D.该反应是放热反应,则SO2的能量一定大于SO3的能量 |
下列分子中所有原子都满足8电子结构的是
| A.光气(COCl2) |
| B.六氟化硫 |
| C.二氟化氙 |
| D.三氟化硼 |
下列情况可能引起大气污染的是
①煤的燃烧;②工业废气的任意排放;③燃放鞭炮;④飞机、汽车尾气的排放
| A.只有①② |
| B.只有②④ |
| C.只有①②③ |
| D.①②③④ |
下列叙述正确的是
A.将 通入 通入 溶液中至饱和,无沉淀产生;再通入 溶液中至饱和,无沉淀产生;再通入 ,产生沉淀 ,产生沉淀 |
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入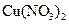 固体,铜粉仍不溶解 固体,铜粉仍不溶解 |
C.向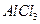 溶液中滴加氨水,产生白色沉淀;再加入 溶液中滴加氨水,产生白色沉淀;再加入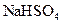 溶液,沉淀消失 溶液,沉淀消失 |
D.向 溶液中滴加少量 溶液中滴加少量 溶液, 溶液, 先发生反应 先发生反应 |
下列说法正确的是
| A.配制H2SO4溶液时,先在量筒中加一定体积的水,然后边搅拌边慢慢加入浓H2SO4 | |
| B.SO2、NO2或CO2都会导致酸雨的形成 | C.酸雨在空气中久置PH减小。 |
| D.提高空气中臭氧的浓度有益于人体健康 |
下列物质中见光会分解的是
①HNO3 ②AgBr③HClO④氨水⑤AgNO3
| A.①③④ | B.①②③⑤ | C.②③④⑤ | D.全部 |