下列说法正确的是
| A.25℃时,pH=3的CH3COOH溶液加水稀释10倍后,pH=4 |
| B.25℃时,pH=11的NaOH溶液加水稀释100倍后,pH=9 |
| C.25℃时,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,pH=7 |
| D.90℃时,纯水的pH=6.2,所以加热可以使水呈酸性 |
冰醋酸CH3COOH沸点较高(117.9℃),且能形成二聚物(CH3COOH)2,其反应式为2CH3COOH(g)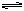 (CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用
(CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用
| A.高温低压 | B.低温低压 | C.加催化剂 | D.低温高压 |
对某已经达到化学平衡状态的可逆反应,如果改变某种条件,使某反应物的浓度减小,则下列说法不正确的是
| A.平衡可能向正反应方向移动 | B.平衡可能向逆反应方向移动 |
| C.生成物的浓度相应增大 | D.平衡可能移动也可能不移动 |
在一密闭容器中进行下列反应:2SO2(g)+O2(g) 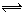 2SO3(g).已知反应过程中某一时刻SO2,O2,SO3的浓度(mol/L)分别为:0.2, 0.1, 0.2. 当该反应达到平衡时可能存在的数据是
2SO3(g).已知反应过程中某一时刻SO2,O2,SO3的浓度(mol/L)分别为:0.2, 0.1, 0.2. 当该反应达到平衡时可能存在的数据是
| A.SO2为0.4mol/L,O2为0.2mol/L | B.SO2为0.25mol/L |
C.SO2, ,SO3均为0.15mol/L |
D.SO3为0.4mol/L |
在一定条件下将1mol的CO和1mol H2O(g)放入密闭容器中发生反应:CO(g)+H2O(g)  CO2(g)+H2(g),达到平衡时测得CO2为0.6mol。再通入4mol H2O(g),达到新平衡后,CO2的物质的量为
CO2(g)+H2(g),达到平衡时测得CO2为0.6mol。再通入4mol H2O(g),达到新平衡后,CO2的物质的量为
| A.小于0.6mol大于0.4mol | B.等于1mol |
| C.大于0.6mol,小于1mol | D.大于1mol |
把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g) H2(g) +I2(g). 在反应趋向平衡状态过程中,下列说法正确的是 ( )
H2(g) +I2(g). 在反应趋向平衡状态过程中,下列说法正确的是 ( )
| A.HI的分解速率小于其生成速率 | B.HI的分解速率等于其生成速率 |
| C.HI的分解速率大于其生成速率 | D.无法判断 |