下列说法正确的是
①具有规则几何外形的固体一定是晶体
②NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
③非极性分子中一定含有非极性键
④晶格能由大到小: NaF> NaCl> NaBr>NaI
⑤含有共价键的晶体一定具有高的熔、沸点及硬度
⑥s-s σ键与s-p σ键的电子云形状相同
⑦含有π键的化合物与只含σ键的化合物的化学性质不同
⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体
| A.①②⑤⑥ | B.③④⑥⑦ | C.②④⑦⑧ | D.③④⑤⑧ |
下列离子方程式正确的是
A.向碳酸镁中加入稀盐酸:CO32-+2H+ =CO2 +H2O +H2O |
| B.硅酸钠溶液与醋酸溶液混合:SiO32- + 2H+ =H2SiO3↓ |
| C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++ 2SO42-+ 2Ba2++ 4OH- =2BaSO4↓ + Al(OH)3↓ + NH3·H2O |
| D.冷的浓硝酸中加入过量铁粉:Fe + 2NO3-+ 4H+=Fe2+ + 2NO2↑ + 2H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.使石蕊呈红色的溶液:NH4+、Ba2+、ClO-、Cl- |
| C.使酚酞呈红色的溶液:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g)=2P2O5(s) ΔH=-a kJ/mol
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH=-b kJ/mol
若a、b均大于零,则a和b的关系为
| A.a<b | B.a=b | C.a>b | D.无法确定 |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物的总能量一定低于反应物总能量 |
| B.吸热反应一定要加热条件才能进行 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件的△H不同 |
| D.用C(s)和CO(g)的燃烧热数据,可以计算化学反应C(s)+1/2O2(g)=CO(g)的焓变 |
下列热化学方程式中,正确的是
| A.甲烷的燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ/mol |
B.500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g)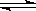 2NH3(g) △H=-38.6 kJ/mol 2NH3(g) △H=-38.6 kJ/mol |
| C.HCl 和NaOH 反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| D.在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol |