为提纯下列物质(括号内为杂质),所选试剂及方法均正确的是
| 选项 |
物质 |
除杂试剂 |
方法 |
| A |
溴苯(溴) |
CCl4 |
分液 |
| B |
NH3(H2O) |
浓硫酸 |
洗气 |
| C |
乙烷(乙烯) |
溴水 |
洗气 |
| D |
CO2(SO2) |
Na2CO3饱和溶液 |
洗气 |
25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是
| A.物质的量浓度相等的三种溶液中,pH大小关系为:pH(NaCN)> pH(Na2 CO3)pH(CH3 COONa) |
| B.amol·L-1 HCN与b mol·L-1 NaOH溶液等体积混合所得的溶液中c(Na+)>c(CN-),则a一定小于b |
| C.向冰醋酸中逐滴加水稀释的过程中,溶液导电能力先增大,后减小 |
| D.将0.1 mol·L-1的Na2 CO3溶液逐滴加入到等浓度的HCN溶液中,无明显现象,说明未反应 |
有关AgCl沉淀的溶解平衡说法正确的是
| A.此时,AgCl沉淀溶解速率为零 |
| B.AgCl难溶于水,溶液中没有Ag+ 和Cl— |
| C.升高温度,AgCl沉淀的溶解度增大 |
| D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是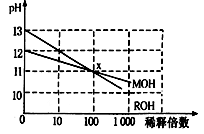
| A.ROH是一种强碱 |
| B.在x点,MOH未完全电离 |
| C.在x点,c(M+)=c(R+) |
| D.稀释前,c(ROH)=10c(MOH) |
下列物质加入水中,能使水的电离度增大,溶液的pH值减小的是
| A.HCl | B.Al2(SO4)3 | C.Na2CO3 | D.NH3·H2O |
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO2+H2O H2CO3 H2CO3 |
C.CO32-+H2O  HCO3-+OH- HCO3-+OH- |
D.HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |