有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化;如果把铜浸入C的盐溶液里,有金属C析出。据此,判断它们的活动性由强到弱的顺序是
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
已知15g化合物A完全氧化,把产物通过浓硫酸和碱石灰,浓硫酸增重9g,碱石灰增重39.6g,用现代物理方法测定:①该有机物的质谱图如图所示②核磁共振仪
|
测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3。
则下列说法正确的是
| A.该有机物的分子式为C9H10O |
| B.该有机物的摩尔质量为150 |
C.该物质的结构简式可能为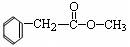 |
| D.该有机物一定不能与Na2CO3反应 |
将有机物的混合物在一定条件下反应:①甲醇与乙醇的混合物与浓硫酸加热得醚;②乙二醇与乙酸酯化得酯;③氨基乙酸和丙氨酸生成二肽;④苯酚和浓溴水反应。所生成的有机物的种类由多到少的顺序是
| A.③②④① | B.④③②① | C.③①②④ | D.①②③④ |
有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出(标准状况下)氢气22.4L,据此推断乙可能是
| A.CH3CHOHCHOHCH3 | B.HOCH2CHOHCH3 | C.CH3CH2CH2OH | D.CH3CHOHCH3 |
某混合气体可能含CO、CO2、NH3、HCl、H2和H2O(g)中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸(增重)、灼热氧化铜(变红)和无水硫酸铜(变蓝)时,下列对原混合气体成分的推断不正确的是
| A.一定有CO2、HCl、H2 | B.可能有CO、H2O |
| C.一定没有NH3、CO2 | D.一定没有NH3、可能有CO |
下列有关实验的叙述中正确的是
| A.用pH试纸粗略测定饱和氯水的pH |
B.做完某种物质的焰色反应实验后,用稀盐酸洗净铂丝,并在火焰上灼烧至没有颜色后,再进行其他物质的焰色反应实验 |
| C.实验室常用如图所示的装置制取少量乙酸乙酯 |
| D.在含FeCl2杂质的FeCl3溶液中通入足量Cl2后,加热蒸干即得纯净的FeCl3固体 |