下列关于能源和作为能源的物质的叙述错误的是
| A.吸热反应的反应物总能量低于生成物总能量 |
| B.绿色植物进行光合作用时,将光能转化为化学能“贮存”起来 |
| C.物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用 |
| D.天然气属于二次能源 |
将含有0.4molNaCl和0.5molCu(NO3)2的水溶液用惰性电极电解一段时间后,在一个电极上得0.3molCu,则在另一个电极上逸出的气体(标准状况下)的体积是()
| A.4.48L | B.5.6L | C.6.72L | D.11.2L |
下列各式中属于正确的水解反应离子方程式的是()。
A.NH4+ + H2O 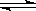 NH3·H2O + H+ NH3·H2O + H+ |
B.S2- + 2H2O 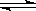 H2S + 2OH- H2S + 2OH- |
C.CH3COOH + H2O 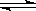 CH3COO- + H3O+ CH3COO- + H3O+ |
D.HS- + H3O+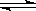 H2S + H2O H2S + H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是()
| A.饱和氯水中:Cl-、NO3-、Na+、SO32- |
| B.c(H+)=1.0×10-13mol/L溶液中:CH3COO-、K+、SO42-、Br- |
| C.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| D.pH=12的溶液中:NO3-、I-、Na+、Al3+ |
若NA为阿伏伽德罗常数,下列叙述错误的是()
| A.46gNO2和N2O4混合气体中含有原子总数为3NA |
| B.1 mol Na 与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| C.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+ |
| D.常温下10L pH=13的NaOH溶液中含有的OH-离子数约为NA |
将质量为m g的铁粉与铜粉的混合物,溶于100mL 4mol·L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为
| A.5.52g | B.(m+6.8)g | C.(m+2.55)g | D.(m+12.0)g |