汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:Pb (s)+ PbO2(s) +2H2SO4(aq)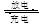 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) |
| C.铅蓄电池属于一次电池 |
| D.电池放电时,溶液酸性增强 |
只用胶头滴管和试管通过两试剂的互滴,不能区别的下列溶液(浓度均为0.1 mol/L)
| A.NaAlO2和稀盐酸 | B.NaHCO3和Ca(OH)2 |
| C.NaOH和Al2(SO4)3 | D.HCl和Na2CO3 |
某溶液中含有Cu2+、Mg2+、Fe2+、Al3+等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
| A.Cu2+ | B.Mg2+ | C.Fe2+ | D.Al3+ |
用NA表示阿伏加德罗常数的值。下列说法正确的是
| A.4 g氦气中含有的分子数和原子数均为NA |
| B.标准状况下,22.4 L CCl4中含有的分子数为NA |
| C.1 L 0.1 mol·L-1乙醇溶液中含有的氧原子数为0.1NA |
| D.1 mol Cl2完全反应转移的电子数一定是2NA |
下列表达中,正确的是
| A.饱和氯水中可大量共存Na+、CO32-、SO32- |
| B.溶液中可大量共存Mg2+、HCO3-、SO42-、OH— |
| C.向稀硝酸中加入过量的铁粉:3Fe+2NO3-+8H+===3Fe2++2NO↑+4H2O |
| D.AlCl3溶液和过量浓氨水混合:Al3++4NH3·H2O===Al(OH)4-+4NH4+ |
汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确的是
| A.用盐的形式表示:BaSiO3·CuSiO3 |
| B.用氧化物形式表示:BaO·CuO·2SiO2 |
| C.易溶于强酸、强碱 |
| D.性质稳定,不易褪色 |