在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用下图简单表示(图中的ΔH表示生成1 mol含硫产物的数据)。由图得出的结论正确的是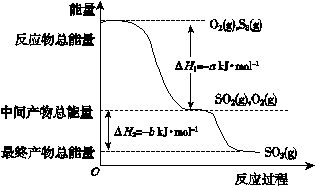
| A.S8(s)的燃烧热ΔH=-8a kJ·mol-1 |
| B.2SO3(g)===2SO2(g)+O2(g) ΔH=-2b kJ·mol-1 |
| C.S8(s)+8O2(g)===8SO2(g)ΔH=-a kJ·mol-1 |
| D.由1 mol S8(s)生成SO2的反应热ΔH=-(a+b) kJ·mol-1 |
在2NO2(红棕色) N2O4(无色)的可逆反应中,下列状态一定达到化学平衡状态的是
N2O4(无色)的可逆反应中,下列状态一定达到化学平衡状态的是
| A.N2O4和NO2的分子数比为1︰2 |
| B.N2O4和NO2的浓度相等 |
| C.单位时间内1 mol N2O4消耗的同时有2 mol NO2生成 |
| D.平衡体系的颜色不再改变 |
2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应PCl3(g) + Cl2(g)  PCl5(g),达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时,PCl5的物质的量是
PCl5(g),达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时,PCl5的物质的量是
| A.0.40 mol | B.0.20 mol |
| C.小于0.20 mol | D.大于0.20 mol,小于 0.40 mol |
下列说法中可以说明密闭容器中的反应:P(g)+Q(g) R(g)+S(g)在恒温下已达平衡状态的是
R(g)+S(g)在恒温下已达平衡状态的是
| A.反应容器内压强不随时间而变化 |
| B.P和S的生成速率相等 |
| C.反应容器内P、Q、R、S四者共存 |
| D.反应容器内总物质的量不随时间而变化 |
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4υ正(O2)= 5υ逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少 |
| D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O) |
在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g) C(g)+D(g)已达到平衡状态的现象是
C(g)+D(g)已达到平衡状态的现象是
| A.混合气体的压强 |
| B.混合气体的密度 |
| C.气体的总物质的量 |
| D.单位时间内生成n mol C的同时消耗2n molB |