由于某一条件的改变使容器的平衡3A(g)+B(g) 2C(g) △H<0,向正反应方向发生了移动。新的平衡状态与原平衡状态相比,下列判断中不正确的是
2C(g) △H<0,向正反应方向发生了移动。新的平衡状态与原平衡状态相比,下列判断中不正确的是
①容器内的温度一定升高
②v正一定变大
③容器中C物质的浓度一定升高
④容器内的压强一定降低
| A.①④ | B.①③ | C.②③④ | D.①②③④ |
下列关于元素周期表和元素周期律的说法错误的是
| A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 |
| B.同一周期元素随着核电荷数增多,非金属性逐渐增强 |
| C.因为Na比K容易失去电子,所以Na比K的还原性强 |
| D.O与S为同主族元素,且O比S的非金属性强 |
X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
| A.HX | B.H2X | C.XH4 | D.XH3 |
往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸,溶液的颜色变化应该是
| A.颜色变浅 | B.变为绿色 | C.没有改变 | D.变棕黄色 |
下列物质能使品红溶液褪色的是
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫
| A.①③④ | B.②④ | C.①②③④ | D.①②③④ |
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是
A. |
B. |
C.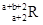 |
D. |