下列离子方程式正确的是
A.NaHS溶液水解的方程式为:HS-+H2O S2-+H3O+ S2-+H3O+ |
| B.向H218O中投入Na2O2固体: 2H218O + 2Na2O2 ===4Na++ 4OH-+ 18O2↑ |
| C.在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2+ + 2Br-+ 2Cl2="==" 2Fe3++Br2+4Cl- |
D.用惰性电极电解饱和氯化钠溶液:2Cl-+2H+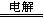 H2↑+Cl2↑ H2↑+Cl2↑ |
对下列四种情况:①崇明岛的形成②用黄豆制豆腐 ③向Fe(OH)3胶体中滴加适量盐酸生成红褐色沉淀 ④钢笔灌用不同牌号蓝墨水易发生堵塞。能用有关胶体的知识解释的是:
| A.② | B.①②④ | C.②③④ | D.①②③④ |
下列说法不正确的是
| A.除去粗盐中的泥沙的提纯步骤为:溶解、过滤、蒸发,且三步中都要用到玻璃棒 |
| B.过滤时,玻璃棒与三层滤纸的一边接触,漏斗下端紧贴烧杯内壁 |
| C.加热蒸发氯化钠溶液时,一直加热到水全部蒸干为止 |
| D.过滤时玻璃棒的作用是引流,蒸发时玻璃棒的作用是搅拌使之受热均匀 |
下列溶液中的Cl-浓度与50mL 1mol/L MgCl2溶液中的C1-浓度相等的是
A.150mL 1 mol/L NaCl溶液 B.75 mL 2 mol/L CaCl2溶液
C.150mL 2 mol/L KCl溶液 D .75 mL 1 mol/LAlCl3溶液
.75 mL 1 mol/LAlCl3溶液
下列叙述正确的是
| A.元素的单质可由氧化或还原含该元素的化合物来制得 |
| B.得电子越多的氧化剂,其氧化性就越强 |
| C.阳离子只能得到电子被还原,只能做氧化剂 |
| D.含有最高价元素的化合物一定具有强的氧化性 |
我县沂山风景区被称为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”。O2ˉ就是一种空气负离子,其摩尔质量为
| A.32 g | B.33 g | C.32 g·molˉ1 | D.33 g·molˉ1 |