(12分)某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率。饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%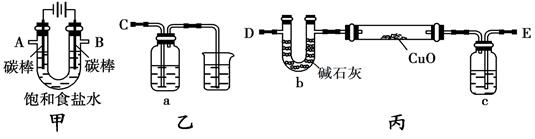
甲方案:利用甲、乙装置测定饱和食盐水的电解率
(1)若饱和食盐水中滴有酚酞,则电解过程中甲装置中的实验现象: 。
(2)若洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,则正确的连接顺序为 连________(填A、B、C、D、E等导管口),则洗气瓶a中发生反应的离子方程式为 。
乙方案:利用甲、丙装置测定饱和食盐水的电解率
(3)对于乙方案,有同学提出有两种方法都可测得饱和食盐水的电解率
Ⅰ.通过测定硬质玻璃管中氧化铜固体前后质量差来计算饱和食盐水的电解率
Ⅱ.通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率
①一同学认为可以在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,则该干燥装置应与 口连接
a.A b.B c.D d.E
②另一同学认为乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,你是否同意?请说明理由 。
丙方案:只利用甲装置测定饱和食盐水的电解率。
(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,求饱和食盐水的电解率 (假设电解前后溶液体积不变,饱和食盐水密度约为1.33 g/mL,溶解度为33.0g)。
(5)若往该电解后所得溶液中通入二氧化碳气体2.24L(标准状况),则所得溶液中各离子浓度大小关系为: 。
(16分)某学习小组设计了如下图所示的实验方案来探究氯气的性质。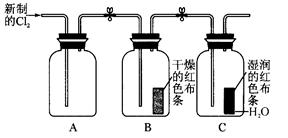
(1)实验时甲同学在A装置中未加入任何试剂,发现B、C中的红色布条均褪色,由此甲同学得出结论:氯气具有漂白性。
实验时乙同学向A装置中加入了某种试剂,发现B中的红色布条不褪色而C中的红色布条褪色,由此乙同学得出结论:氯气没有漂白性。
你认为乙同学向A装置中加入的试剂是 ,甲、乙同学的结论正确的是 。
(2)丙同学思考后认为上面的实验装置存在缺陷,并提出了解决方法。你认为存在的缺陷是 ,解决方法为(用化学方程式表示) 。
(3)丁同学在A装置中加入滴有酚酞的NaOH溶液,观察到A装置中溶液红色逐渐褪去。他提出两种可能原因:①氯气与水反应生成次氯酸,次氯酸具有强氧化性将酚酞氧化使溶液褪色;②氯气与NaOH溶液反应使溶液褪色。请你帮助他设计一个简单的实验验证褪色的原因(简述实验步骤)。
。
(6分)(1)某学生进行中和热测定,取用50 mL 0.50 mol·L-1的HCl和50 mL 0.55 mol·L-1的NaOH溶液(密度都是1 g·cm-3)。实验后得到以下数据: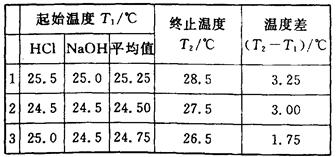
(中和后生成的溶液的比热容为4.18J·g-1·℃-1)请替该同学计算出中和热的平均值: .
(2)该学生测得的数据比理论值 (填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母) .
| A.溶液混合后未及时盖好量热计杯盖 |
| B.倾倒溶液太快,有少量溅出烧杯 |
| C.溶液混合后搅拌不够 |
| D.未等温度升到最高值就记录温度计示数 |
E.用量筒量取盐酸体积时仰视读数
F.烧杯和玻璃棒吸收了一部分热量
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]:测定硫元素的含量
将m1g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。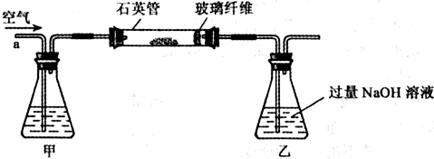
写出石英管中发生反应的化学方程式为:
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理: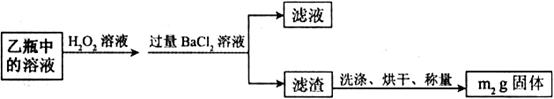
问题讨论:
(1)I中,甲瓶内所盛试剂是____________溶液。乙瓶内发生反应的离子方程式有________________________、________________________。
(2)Ⅱ中,所加H2O2溶液需足量的理由是_______________________。
(3)该黄铁矿石中硫元素的质量分数为____________________________ 。
[实验二]:设计以下实验方案测定铁元素的含量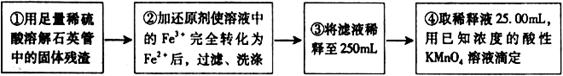
问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗?。
若不合理,会如何影响测量结果:_______________(若合理,此空不答)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是 。
a.把过量的铁粉与稀HNO3反应
b.把铁粉与过量的稀HNO3反应
c.先把铁粉灼烧,再溶解于稀HNO3 中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+。检验Fe2+的方法: ,甲同学观察到的实验现象为: ,甲同学检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2。请写出在酸性条件下NO3-氧化Ag的离子方程式: 。并帮乙同学完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法)。
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| ①测定上述实验用的Fe(NO3)3溶液的pH值 |
|
| ② |
某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。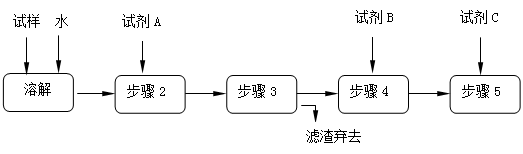
(1)溶解所需玻璃仪器是;步骤3的操作名称是
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠
假设2:只含有
假设3:氯化钠和氢氧化钠都含有
(3)设计实验方案,进行试验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是_______________________。
②填写下表:
| 实验步骤 |
预期现象和结论 |
| 步骤4: |
|
| 步骤5: |