(10分)硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1所示。
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示。
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的 (填编号)。
A.NaOH溶液 B.浓H2SO4
C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式_________________ 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO42-全部转化为Cr2O2-7;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O。I2+2S2O32-=S4O62-+2I-,则该废水中Ba2+的物质的量浓度为 。
右图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略 ),其原理与教材中的实验完全相同。
),其原理与教材中的实验完全相同。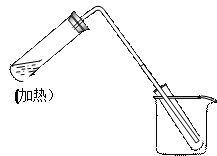
回答下列问题:
(1)左边大试管中要加入几片碎瓷片,其作用是
(2)该装置中使用的玻璃管较长,其作用是
(3)烧杯中还应该加入的物质是
实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
(1)溶解时
(2)过滤时
(3)蒸发时
可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒
(2)除去NaCl晶体中混有的碘单质
(3)分离石油中各不同沸点范围的成分
(4)分离水和苯的混合物
CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++4C1一 [CuCl4]2- +4H2O
[CuCl4]2- +4H2O
蓝色黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
⑴
⑵。
如右图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5 mL 盐酸于试管中.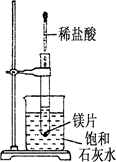
试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式:
(4)由实验推知,MgCl2溶液和H2的总能量(填“大于”“小于”或“等于”)镁片和盐酸的总能量.