A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
| 元素 |
有关性质或结构信息 |
| A |
负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B |
B原子得到一个电子后3p轨道全充满 |
| C |
C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D |
D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
| E |
E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B) I1(Y)(填“>”“=”或“<”);
(2)E元素原子的核外电子排布式为__________;
(3)盐X的水溶液呈 (填“酸性”“碱性”或“中性”);
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是___________________;
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:_______________。
在容积可变的密闭容器中,可逆反应2HI(g) H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:
H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:
(1)正反应速率______________;
(2)逆反应速率______________;
(3)平衡______________;
(4)容器内颜色______________;
(5)H2的质量分数______________;
(6)混合气体的平均相对分子质量______________;
(7)H2的浓度______________;
(8)HI的分解率______________;
(9)混合气体的密度______________;
(10)混合气体的质量______________。(用“变大”“变小”“不变”“加深”“变浅”填写)
将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2+O2 2CO+O2
2H2+O2 2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_________和_________,或_________和_________ (填它们的化学式)。
(2)若平衡时O2和CO2的物质的量分别为n平(O2)="a" mol,n平(CO2)="b" mol。试求n平(H2O)="________" (用含a、b的代数式表示)。
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题: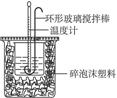
中和热的测定
(1)烧杯间填满碎泡沫塑料的作用是_______________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值_____________。(填“偏大”“偏小”或“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量_____________(填“相等”“不相等”),所求中和热_____________(填“相等”“不相等”),简述理由:______________________________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____________(填“偏大”“偏小”“无影响”)。
在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如上图)。
容器中发生以下反应:N2+3H2 2NH3(正反应放热),若反应达到平衡后,测得混合气体为7体积。据此回答下列问题:
2NH3(正反应放热),若反应达到平衡后,测得混合气体为7体积。据此回答下列问题:
(1)保持上述温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各物质的体积分数仍与上述平衡时完全相同。那么:①若a=1,c=2,则b=_________,在此情况下,反应起始时将向_____________(填“正”或“逆”)方向进行。
②若需规定起始时,反应向逆方向进行,则c的范围是___________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是_________,原因是______________________________。
在一固定容积的密闭容器中,在一定条件下进行以下化学反应:A(g)+2B(g) 3C(g)。已知加入1 mol A和3 mol B,且达到化学平衡后,生成了a mol C。
3C(g)。已知加入1 mol A和3 mol B,且达到化学平衡后,生成了a mol C。
(1)达到化学平衡时,C在反应混合气中物质的量百分含量为_________(用字母a表示)。
(2)在相同实验条件下,若在同一容器中改为加入2 mol A和6 mol B,达到化学平衡后,C的物质的量为________mol(用字母a表示)。此时C在反应混合气体中的物质的量的百分含量_________(填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,并要求达到化学平衡后C在反应混合气体中的百分含量不变,则还应加入C_________mol。