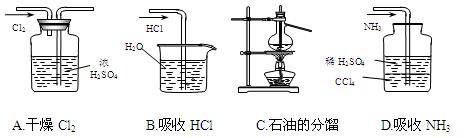
用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是
如图所示烧杯中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是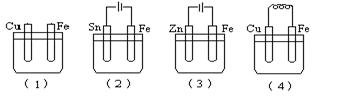
| A.(4)(3)(2)(1) | B.(4)(2)(1)(3) | C.(3)(4)(1)(2) | D.(4)(3)(1)(2) |
已知:CH3CH2CH2CH3(g)+6.5O2(g) 4CO2(g)+5H2O(l);DH =-2878 kJ
4CO2(g)+5H2O(l);DH =-2878 kJ
(CH3)2CHCH3(g)+6.5O2(g) 4CO2(g)+5H2O(l);DH =-2869 kJ
4CO2(g)+5H2O(l);DH =-2869 kJ
下列说法正确的是
| A.异丁烷分子中的碳氢键比正丁烷的多 |
| B.正丁烷分子的能量大于异丁烷分子 |
| C.异丁烷转化为正丁烷的过程是一个放热过程 |
| D.正丁烷的稳定性大于异丁烷 |
能正确表示下列化学反应的离子方程式的是
| A.金属钾投入水中 K + H2O = K+ + OH—+ H2↑ |
| B.湿法炼铜 Fe3+ + Cu = Fe2++ Cu2+ |
| C.用食醋除水垢 CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O |
D.电解饱和食盐水 2Cl—+ 2H2O  H2 ↑+ Cl2↑+ 2OH— H2 ↑+ Cl2↑+ 2OH— |
某烃的分子式中含有一个苯环,两个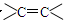 和一个—C≡C—,则它的分子式可能为
和一个—C≡C—,则它的分子式可能为
| A.C9H12 | B.C17H20 | C.C20H30 | D.C12H20 |