体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2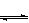 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
下列食品添加剂与其说明错误的是
| A.食醋——酸味剂 | B.亚硝酸钠——咸味剂 |
| C.碳酸氢钠——疏松剂 | D.苯甲酸——防腐剂 |
不属于“雾霾”等灾害性天气治理的措施是
| A.外出时使用PM2.5口罩,减少有害物质的吸入 |
| B.改燃煤为燃气,可减少废气中SO2等有害物质的量 |
| C.利用太阳能、潮汐能、风力发电,以获取清洁能源 |
| D.使用“乙醇汽油”,减少汽车尾气中有害气体的排放 |
下列物质中,不属于合金的是
| A.硬铝 | B.水银 | C.黄铜 | D.钢铁 |
人体内所必须需的下列元素中,因摄入量不足而导致骨质疏松的是
| A.K | B.Ca | C.Na | D.Fe |
人们在日常生活中大量使用各种高分子材料,下列说法正确的是
| A.天然橡胶易溶于水 |
| B.羊毛是合成高分子材料 |
| C.聚乙烯塑料是天然高分子材料 |
| D.酚醛塑料(俗称电木)不可以进行热修补 |