除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和方法不正确的是
| |
混合物 |
试剂 |
分离方法 |
| A |
苯(苯酚) |
氢氧化钠溶液 |
分液 |
| B |
甲烷(乙烯) |
酸性高锰酸钾溶液 |
洗气 |
| C |
乙酸乙酯(乙酸) |
碳酸钠溶液 |
分液 |
| D |
乙炔(硫化氢) |
硫酸铜 |
洗气 |
工业上常利用CO与SO2反应生成固态S单质和CO2,从而消除这两种气体对大气的污染:2CO(g)+SO2(g) 2CO2(g)+S(s)△H=﹣a kJ/mol(a>0),下列叙述正确的是
2CO2(g)+S(s)△H=﹣a kJ/mol(a>0),下列叙述正确的是
A.该反应的平衡常数表达式为K=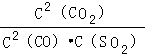 |
| B.若反应开始时投入2 mol CO,则达平衡时,放出热量为a kJ |
| C.增大压强或升高温度都可以加快化学反应速率并提高SO2的转化率 |
| D.若单位时间内生成2 molCO2的同时,消耗1mol SO2,则说明反应达到平衡状态 |
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ·mol﹣1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是
CH3OH(g)+H2O(g)△H=﹣49.0kJ·mol﹣1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是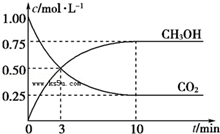
| A.欲增大平衡状态时c(CH3OH)/c(CO2)的比值, 可采用 升高温度的方法 |
| B.3 min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同 |
| C.欲提高H2的平衡转化率只能减小反应容器的体积 |
| D.从反应开始到平衡,CO2的平均反应速率v(CO2)="0.025" mol·L﹣1·min﹣1 |
已知:NO2(g)+SO2(g) SO3(g)+NO(g),现将体积之比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
SO3(g)+NO(g),现将体积之比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
| A.体系压强保持不变 |
| B.混合气体颜色保持不变 |
| C.SO3与NO的体积比保持不变 |
| D.每消耗1molSO2,同时生成1molNO |
根据反应:S2O32﹣+2H+═SO2+S↓+H2O,下表各组实验最快出现浑浊的是
| Na2S2O3溶液 |
稀H2SO4 |
H2O |
温度/℃ |
|||
| c(mol·L﹣1) |
V(mL) |
c(mol·L﹣1) |
V(mL) |
V(mL) |
||
| A |
0.1 |
5 |
0.1 |
5 |
5 |
10 |
| B |
0.2 |
5 |
0.1 |
5 |
10 |
10 |
| C |
0.1 |
5 |
0.1 |
5 |
10 |
30 |
| D |
0.2 |
5 |
0.1 |
5 |
10 |
30 |
对已达化学平衡的反应:2X(g)+Y(g) 2Z(g),减小压强后,对反应产生的影响是
2Z(g),减小压强后,对反应产生的影响是
| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正反应速率先减小后增大,逆反应速率减小,平衡向逆反应方向移动 |
| D.逆反应速率先减小后增大,正反应速率减小,平衡向逆反应方向移动 |