已知:xA(g)+yB(g) zC(g);△H=a。将xmolA和ymolB混合在密闭容器中,在不同温度(T1>T2)及压强(P1>P2)下,C的物质的量n(C)与反应时间(t)的关系如图所示。下列判断正确的是
zC(g);△H=a。将xmolA和ymolB混合在密闭容器中,在不同温度(T1>T2)及压强(P1>P2)下,C的物质的量n(C)与反应时间(t)的关系如图所示。下列判断正确的是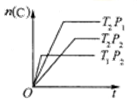
A.x+y=z;a>0 B.x+y>z;a<0
C.x+y<z;a<0 D.x+y<z;a>0
下列化学用语正确的是
| A.乙烯的结构简式:CH2CH2 |
B.氟原子的结构示意图: |
C.甲烷的电子式: |
| D.碳酸钠的电离方程式:Na2CO3=Na++CO32- |
将秸秆、粪便等转化为沼气,既可获得清洁能源又可改善环境质量。沼气的主要成分是
| A.CO | B.CH4 | C.H2 | D.H2S |
某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42- 等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列说法一定正确的是
| A.一定存在H+、Mg2+、Al3+、NH+4,一定不存在Na+、SO2-4、Fe3+ |
| B.一定存在H+、Al3+、NH+4、SO2-4,可能存在Na+、Mg2+ |
| C.溶液中c(H+)∶c(Al3+):c(Mg2+)为1∶1∶1 |
| D.溶液中c(H+)∶c(SO2-4)为2∶9 |
短周期主族元素A、B、C、D的原子序数依次增大。A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.非金属性:A>C
B.原子半径:B<C<D
C.最高价氧化物对应水化物的酸性:D<C
D.单质B常温下能溶于浓硝酸
下列除杂质选用试剂和主要操作都正确的是
| 物质 |
杂质 |
试剂 |
主要操作 |
|
| A |
SiO2 |
Fe2O3 |
盐酸 |
过滤 |
| B |
NaHCO3 |
NH4Cl |
— |
加热 |
| C |
铁粉 |
铜粉 |
稀硫酸 |
过滤 |
| D |
甲烷 |
乙烯 |
溴水 |
蒸馏 |