下列说法中正确的是
| A.乙醛与新制Cu(OH)2悬浊液反应生成红色的Cu2O沉淀 |
| B.银镜反应中醛发生的是还原反应 |
| C.甲醛、乙醛、丙醛都没有同分异构体 |
| D.醛类催化加氢后都能得到饱和一元醇 |
Ⅰ.已知在常温常压下:
① 2CH3OH(l)十3O2(g)=2CO2(g)+4H2O(g)△H= -1275.6 kJ·mol—1
② H2O(l)=H2O(g)△H="+" 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式。
Ⅱ.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:

(1)在Na3PO4溶液中,c(Na+)/c(PO43-)3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是。(填选项字母)
A、C(Na+)> C(H2PO4 -)> C(H+)> C(HPO4 2-)> C(H3PO4 )
B、C(Na+)> C(H2PO4 -)> C(OH-)> C( H3PO4)> C(HPO4 2- )
C、C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )
D、C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )
(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh(写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
Ⅲ.化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。电化学降解NO3-的原理如图所示。电源正极为(填A或B),阴极反应式为。
下列实验不能达到预期目的的是:( )
| 序号 |
实验操作 |
实验目的 |
| A |
取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊 |
确定NaHCO3溶液中是否混有Na2CO3 |
| B |
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 |
说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C |
测定等浓度的HCl、HNO3两溶液的pH |
比较氯、N的非金属性强弱 |
| D |
将充满NO2的密闭玻璃球浸泡在热水中 |
研究温度对化学平衡移动的影响 |
下图是元素周期表的一部分,下列说法正确的是( )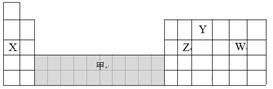
| A.可在灰色区域“甲”中寻找催化剂 |
| B.离子半径:W-﹥Y3-﹥X+ |
| C.气态氢化物的稳定性:Z﹥W |
| D.工业上电解X和W化合物的水溶液制备X |
高炉炼铁过程中发生的反应: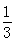 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
A.△H<0
B.该反应的平衡常数表达式是K=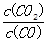
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以降低CO的平衡转化率
下列有关物质的性质和该性质的应用均正确的是( )
| A.常温下浓硫酸能使铝发生钝化,故可在常温下用铝制容器贮藏运输浓硫酸 |
| B.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C.二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |