氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 H2+2NiO(OH) 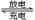 2Ni(OH)2。下列叙述正确的是
2Ni(OH)2。下列叙述正确的是
| A.电池放电时,电池负极周围溶液的pH不断增大 |
| B.电解质溶液可以是稀硫酸 |
| C.外电路中每通过0.2mol电子,H2的质量理论上减小0.2g |
| D.电池工作时,电子由正极通过外电路流向负极 |
室温下,取浓度相同的NaOH溶液和HCl溶液,以体积比3:2相混合,所得溶液的pH=12,则原溶液的浓度为
| A.0.01mol/L | B.0.017mol/L | C.0.05mol/L | D.0.50mol/L |
下列叙述正确的是
| A.当溶液中c(H+)=c(OH-)>10-7 mol/L时,其pH<7,溶液呈现酸性 |
| B.室温下,pH=3的盐酸和pH=11的氨水等体积混合后,溶液中离子浓度关系是: c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| C.Na2CO3溶液中存在c(OH-)= c(HCO3-) +2 c(H2CO3) + c(H+) |
| D.0.1mol/LNaHCO3中c(Na+)= c(HCO3-) + c(H2CO3) = 0.1mol/L |
在平衡体系Ca(OH)2(s) 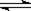 Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使pH增大的是
Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使pH增大的是
| A.加入少量MgCl2固体 | B.加入少量HCl溶液 |
| C.加入少量KCl固体 | D.加入少量Ba(OH)2固体 |
在恒温时,一固定容积的容器内发生如下反应:2NO2(g) 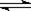 N2O4(g) 达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后, NO2的体积分数
N2O4(g) 达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后, NO2的体积分数
| A.不变 | B.增大 | C.减小 | D.无法判断 |