莽草酸可用于合成药物达菲,结构简式如图,关于莽草酸的说法不正确的是
| A.分子式为C7H10O5 |
| B.分子中含有3种官能团 |
| C.可发生加成反应和酯化反应 |
| D.在水溶液中羧基和羟基均能电离出H+而使溶液显酸性 |
下列各表述与示意图一致的是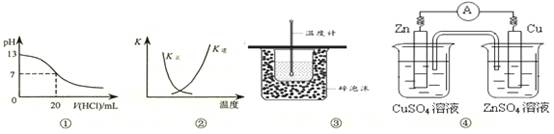
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| C.图③装置用于测定中和热 |
| D.图④装置可以构成锌、铜、硫酸铜溶液原电池 |
现有X、Y、Z、W四种短周期元素,原子半径:r(X)>r(Y) >r(Z) >r(W)。X、Y、Z处于同一周期,Z、W处于同一主族;X、Y、Z的原子序数之和为40。下列说法中正确的是
| A.Y的最髙价氧化物对应的水化物一定是强碱 |
| B.Z 一定位于第三周期VIIA族 |
| C.若X、Y、W可形成化合物XYW2,则该化合物的水溶液呈碱性 |
| D.X与足量的W加热反应会生成化合物X2W |
下表中对实验操作、现象的描述及对应的解释、结论正确的是
| 选项 |
实验操作、现象 |
解释、结论 |
| A. |
铜片放入浓硫酸中,无明显变化 |
铜在冷的浓硫酸中会发生钝化 |
| B. |
往某氯化物溶液中滴加氨水,产生白色沉淀 |
该氯化物是AlCl3 |
| C. |
将10ml某pH=3的HA溶液加水稀释到100ml,所得溶液pH=3.8 |
HA是弱酸 |
| D. |
往MgCl2溶液中滴加NaOH溶液,调至pH=9时,开始出现沉淀[已知Mg(OH)2的Ksp=5.6×10-12] |
原溶液中 c(Mg2+)=5.6×10-2mol·L-1 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.密闭容器中,0.1 molN2和0.3mol H2在催化剂作用下充分反应生成NH3分子数为0.2NA |
| B.1 mol过氧化钠投入足量水中,反应后转移的电子数目为NA |
| C.在0.1 mol·L-1的碳酸钾溶液中,阴离子数目大于0.1NA |
| D.4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5 NA |
下列有关Ksp说法正确的是
| A.某温度下, CaSO4溶液中C(Ca2+) ·C(SO42-)就是 Ksp |
| B.25 ℃时, Fe(OH)3固体在0.01mol/LNH4Cl溶液中的溶解度增大,其Ksp也增大。 |
C.在一定条件下实现BaSO4+Na2CO3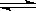 BaCO3+ Na2SO4,说明KSP(BaSO4)>KSP(BaCO3) BaCO3+ Na2SO4,说明KSP(BaSO4)>KSP(BaCO3) |
| D.升高温度,若某沉淀溶解平衡逆向移动, Ksp也变小 |