下列化学反应的离子方程式正确的是
| A.氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+===Fe2++2H2O |
| B.醋酸与NaHCO3溶液反应:H++HCO3-===CO2↑+H2O |
| C.向KI溶液中加入FeCl3溶液:Fe3++2I—===Fe2++I2 |
| D.将铝片加入烧碱溶液中:2Al+2OH-+2H2O===2AlO2-+3H2↑ |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为。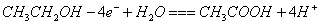
下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
C.电池反应的化学方程式为: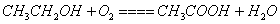 |
D.正极上发生的反应是: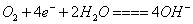 |
下列表述正确的是
| A.0.1mol·L-1Na2CO3溶液中:[OH-]=[HCO3-]+[H+]+[H2CO3] |
| B.0.1mol·L-1CH3COONa溶液中:[Na+]=[CH3COO-]+[OH-] |
| C.CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH) <c (Na2CO3) <c(CH3COONa) |
| D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:[CH3COO-]>[Na+]>[OH-]=[H+] |
下列离子方程式中,书写正确的是
A.弱酸酸式盐NaHB在水溶液中水解:HB–+H2O H3O++B2– H3O++B2– |
B.电解饱和食盐水:C1-+2H2O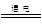 H2↑+Cl2↑+OH- H2↑+Cl2↑+OH- |
| C.氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e-=4OH- |
| D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH==- Q1 ;
2H2(g)+O2(g) →2H2O(g)ΔH==- Q2; H2O(g) →H2O(l)ΔH==- Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 | C.4Q1+2Q2 | D.4Q1+0.5Q2+9Q3 |
在四种化合物①NaHCO3②Al(OH)3③(NH4)2S④H2NCH2COOH中,跟盐酸和氢氧化钠溶液都能反应的是
| A.②④ | B.①② | C.①②③ | D.①②③④ |