能正确表示下列反应的离子方程式是
A.足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+ = Fe2++S↓+2H |
| B.少量铁与稀硝酸反应:3Fe+8H++2NO3-=3Fe2++4H2O+2NO↑ |
| C.向AlCl3溶液中滴入过量氨水:Al3++4NH3∙H2O=AlO2-+4NH4++2H2O |
| D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+H+ +SO42-=BaSO4↓+H2O |
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l)ΔH1 =-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3 =-Q3kJ/mol
若使0.5mol乙醇液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)
| A.Q1+Q2+Q3 |
| B.0.5(Q1+Q2+Q3) |
| C.0.5 Q2-1.5 Q1-0.5Q3 |
| D.1.5 Q1-0.5 Q2+0.5Q3 |
下列热化学方程式中的ΔH能表示可燃物的燃烧热的是
| A.1/2H2(g)+1/2Cl2(g)=HCl(g);ΔH =-92.3kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH =-802.3kJ/mol |
| C.2H2(g)+O2(g)=2H2O(l);ΔH =-571.6kJ/mol |
| D.CO(g)+1/2O2(g)=CO2(g);ΔH =-283kJ/mol |
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A. (W)=3 (W)=3 (Z) (Z) |
B.2 (X)=3 (X)=3 (Z) (Z) |
C.2 (X)= (X)= (Y) (Y) |
D.3 (W)=2 (W)=2 (X) (X) |
化学反应中通常伴随着能量变化,下列说法中错误的是
| A.煤燃烧时将部分化学能转化为热能 |
| B.电解熔融Al2O3时将部分化学能转化为电能 |
| C.TNT爆炸时将部分化学能转化为动能 |
| D.镁条燃烧时将部分化学能转化为光能 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g)ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
| A.点a的正反应速率比点b的小 |
| B.点c处反应达到平衡 |
C.点d( 时刻)和点e( 时刻)和点e( 时刻)处n( 时刻)处n(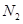 )不一样 )不一样 |
D.其他条件不变,773K下反应至 时刻,n(H2)比上图 时刻,n(H2)比上图 |
中d点的值大