酸式盐NaHB在水溶液中,HB—的电离程度小于HB—的水解程度,下列说法正确的是
A.HB—水解方程式:HB-+H2O H3O+ +B2- H3O+ +B2- |
| B.溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-) >c(H+) |
| C.NaHB的存在抑制了水的电离 |
| D.相同物质的量浓度溶液的pH值:NaHB > Na2B |
下列关于有机化合物的说法正确的是()
| A.戊烷(C5H12)有两种同分异构体 |
| B.乙酸和乙酸乙酯可用Na2CO3溶液加以区别 |
| C.乙烯、聚氯乙烯和苯分子均含有碳碳双键 |
| D.糖类、油脂和蛋白质均可发生水解反应 |
下列说法正确的是()
| A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| C.25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)> V(NaOH) |
| D.AgCl易转化为AgI沉淀且KSP(AgX)=c(Ag+)∙ c(X−),故KSP(AgI) > KSP(AgCl) |
已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是()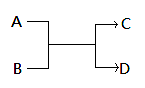
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
常温下,下列各组离子在指定溶液中一定能大量共存的是()
| A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN−、SO42− |
| B.pH=0的溶液:Al3+、Ag (NH3)2+、Cl−、SO42− |
| C.c(H+)/c(OH−)=10−10的溶液:K+、Ba2+、NO3−、Cl− |
| D.c( ClO− )=1.0 mol·L−1的溶液:Na+、SO32−、S2−、SO42− |
设NA为阿伏加德罗常数,下列说法正确的是()
| A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
| B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L |
| C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA |
| D.100ml1mol/LAlCl3溶液中含的阳离子数为0.1NA |