把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
| A.0.1 ( b – 2a ) mol/L | B.10 ( 2a – b ) mol/L |
| C.10 ( b – a ) mol/L | D.10 ( b – 2a ) mol/L |
25℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是()
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×108 |
| C.1∶20∶1010∶109 | D.1∶10∶104∶109 |
常温下,下列各组离子在指定溶液中能大量共存的是()
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl- |
| D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
下列叙述正确的是()
| A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=1×10-14 |
| B.c(H+)等于1×10-7 mol/L的溶液一定是中性溶液 |
| C.0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍 |
| D.任何浓度的溶液都可以用pH来表示其酸碱性的强弱。 |
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡下列叙述正确的是()
CH3COO-+H+,对于该平衡下列叙述正确的是()
| A.加入水时,平衡逆向移动 |
| B.加入少量NaOH固体,平衡正向移动 |
| C.加入少量0.1 mol·L-1盐酸,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡正向移动 |
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如下图所示。下列说法正确的是()
| A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
B.V(NaOH)=10.00 mL 时,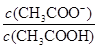 >1 >1 |
| C.pH=7时,两种酸所用NaOH溶液的体积相等 |
| D.V(NaOH)=20 .00 mL 时,c(Cl-)<c(CH3COO-) |