500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后(假设溶液体积不变),两极均收集到22.4 L气体(标准状况)。下列说法正确的是
| A.上述电解过程中共转移2 mol电子 |
| B.电解后溶液中c(H+)为4mol/L |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.原混合溶液中c(K+)为1 mol/L |
下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
| A.Zn+Ag2O+H2O===Zn(OH)2+2Ag |
| B.Pb+PbO2+2H2SO4===2PbSO4+2H2O |
| C.Zn+CuSO4===Cu+ZnSO4 |
D.C+CO2 2CO 2CO |
对于原电池的电极名称叙述有错误的是( )
| A.发生氧化反应的为负极 |
| B.正极为电子流入的一极 |
| C.比较不活泼的金属为负极 |
| D.电流的方向由正极到负极 |
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )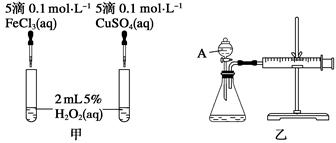
| A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C.用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
100 mL 6 mol·L-1的H2SO4跟过量锌粉反应,在一定温度下,要想减缓反应进行的速率,但又不影响生成的氢气的总量,可向反应物中加入适量的( )
| A.硫酸钠固体 | B.稀盐酸 |
| C.硫酸钾溶液 | D.硝酸钾溶液 |
把下列四种X溶液,分别加入盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时X和盐酸缓慢地进行反应。其中反应速率最大的是( )
| A.20 mL 3 mol·L-1的X溶液 |
| B.20 mL 2 mol·L-1的X溶液 |
| C.10 mL 4 mol·L-1的X溶液 |
| D.10 mL 2 mol·L-1的X溶液 |