选做
(1)写出有机物的系统命名: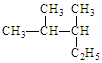 。
。
(2)键线式 表示的分子式为;名称是 。
表示的分子式为;名称是 。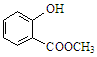 中含有的官能团的名称为 。
中含有的官能团的名称为 。
(3)丁基的4个结构简式为_______________________。
以下是 依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
(1)上述第一级分类标准(分成A、B组的依据)是。
(2)F组中物质除了Cl2外还有(填化学式)
(3)D组中的氨水呈弱碱性,用电离方程式表示呈弱碱性的原因:。
(4)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,说明理由:。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,其中物质E是气体丙的水溶液,物质H是红褐色沉淀。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。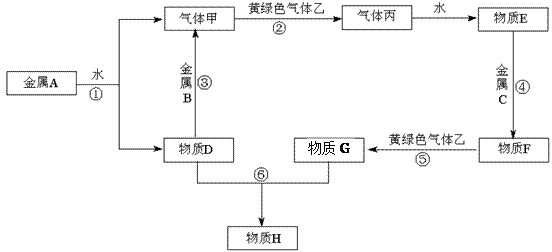
请根据以上信息回答下列问题:
⑴写出A、C、丙的化学式:
A、 C、丙
⑵写出反应③的化学方程式:,
反应⑤的离子方程式:。
已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-中的若干种离子组成,进行如下实验:
第一步: 加入过量的稀盐酸,有白色沉淀生成。
加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试 纸变蓝色的气体。
纸变蓝色的气体。
根据实验现象回答:
(1)分别写出第二步和第三步中所涉及的反应的离子方程式:
第二步: ,
第三步: ;
(2)待测液中 一定含有、NO3-离子,一定不含有离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程),。
一定含有、NO3-离子,一定不含有离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程),。
9.5gMgCl2固体溶于水配成500mL溶液,其浓度为mol·L-1,从中取出100mL溶液,其中Cl-的浓度为mol·L-1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为mol·L-1。
(1 6分)一种烃的含氧衍生物C是生活中的食用香料(G相对分子质量为l 92),可以通过下列途径合成: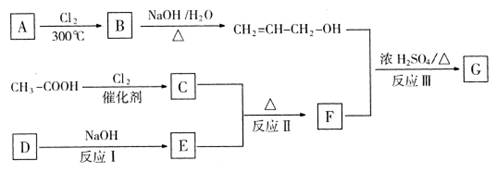
已知:
回答下列问题:
(1)将1.92g G在足量氧气中燃烧,燃烧产物依次通过足量浓硫酸、碱石灰;浓硫酸、碱石灰分别增重1.08 g、4.84g,则G的化学式为。
(2)D遇FeCl3溶液会产生紫色,D的分子中一定含有的官能团名称为:;在E的溶液中通人CO2出现的现象是。
(3)写出指定物质结构简式:A:;F:。
写出反应Ⅲ的化学方程式:;产物G可以发生的反应类型有。
①消去②加聚③酯化④水解⑤中和⑥氧化
(4)F有多种酯类的同分异构体,写出满足下列条件的同分异构体的结构简式:
①能与FeCl3溶液发生显色反应②能发生银镜反应③一硝基取代物只有2种。