如下图所示,X为铁、Y是石墨电极,a是饱和食盐水,实验开始前,在U形管的两边同时各滴入几滴酚酞试液,下列叙述错误的是
| A.合上K1、断开K2,该装置可以将化学能转变为电能 |
| B.合上K1、断开K2,X是阴极,Y电极附近溶液慢慢变为红色 |
| C.合上K2、断开K1,湿润的KI淀粉试纸靠近Y电极管口,试纸变蓝 |
| D.合上K2、断开K1,电解一段时间,X电极附近溶液呈红色 |
硫酸、盐酸和硝酸与烧碱和纯碱并称为工业上的“三酸两碱”。下列说法正确的是
| A.等质量的铝与足量的烧碱和盐酸反应生成氢气的质量相同 |
| B.等质量的铜与足量的浓硫酸和浓硝酸反应生成气体的物质的量相同 |
| C.相同物质的量的烧碱和纯碱与足量盐酸反应,消耗盐酸的体积相同 |
| D.相同质量的硫与足量烧碱、浓硫酸、浓硝酸反应,转移电子数相同 |
A、B、C、D、E为短周期元素,其原子序数依次增大。其中A的最外层电子数为其周期数的2倍;B和D为同主族元素,其中B的氢化物在常温下为液态;C的+1价离子比E的-1价离子少8个电子。则下列说法正确的是
A.D氢化物的稳定性比B氢化物的稳定性强
B.5种元素中,E元素氧化物的水合物的酸性最强
C.A与B、D分别可形成AB2、AD2的化合物
D.B和C可形成离子化合物,且C离子的半径大于B离子的半径
下列有关图像的叙述错误的是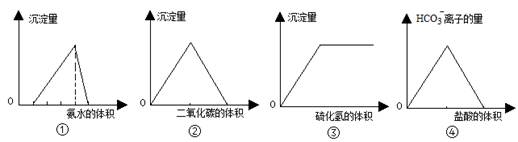
| A.①图可表示向酸化的AlCl3溶液中逐滴加入稀氨水,沉淀量与氨水体积的关系 |
| B.②图中可表示向澄清石灰水中通入二氧化碳气体,沉淀量与二氧化碳体积的关系 |
| C.③图中可表示向亚硫酸溶液中通入硫化氢,沉淀量与硫化氢气体的关系 |
| D.④图中可表示向碳酸钠溶液中逐滴加入稀盐酸,HCO3-离子的量与盐酸体积的关系 |
氯化亚砜(SOCl2,结构式如图)主要用于制造酰基氯化物,其工业制备原理:SO3+SCl2=SOCl2+SO2,
下列有关说法正确的是
| A.SCl2和SOCl2中S的化合价分别为+2、+4价 |
| B.制备反应中,二氧化硫是氧化产物 |
| C.每消耗1mol SCl2,转移1mol电子 |
| D.SOCl2分子中既含有离子键又含有共价键 |
下列由相关实验现象所推出的结论正确的是
| A.铁在常温下不溶于浓硝酸,说明铁与浓硝酸不反应 |
| B.将氯气溶于水后溶液呈浅黄绿色,说明氯气与水没有完全反应 |
| C.将某气体通入品红溶液中溶液褪色,说明该气体一定是二氧化硫 |
| D.向溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- |