已知 2SO2+O2  2SO3为放热反应,对该反应的下列说法中正确的是
2SO3为放热反应,对该反应的下列说法中正确的是
| A.O2的能量一定高于SO2的能量 |
| B.SO2和O2的总能量一定高于SO3的总能量 |
| C.SO2的能量一定高于SO3的能量 |
| D.因该反应为放热反应,故不必加热就可发生 |
下列离子方程式书写正确的是()
A.用铂电极电解氯化镁溶液:Cl---+2H2O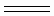 Cl2↑+H2↑+2OH--- Cl2↑+H2↑+2OH--- |
| B.氟气与水反应:F2 +H2O==H+ + F-- +HFO |
C.NaHSO3溶液呈弱酸性是因为:HSO3--- +H2O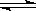 SO32-- + H3O+ SO32-- + H3O+ |
| D.沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:FeCl3 +3H2O="=" Fe(OH)3↓+ 3HCl |
取两个相同容积的密闭恒容容器,在A容器中充入0.2molN2O4, B容器中充入0.2molHI气体,在一定温度下时反应分别达到平衡,测得N2O4和HI的分解率分别为α(A)和α(B)。在该平衡体系中再分别充入0.2molN2O4和0.2molHI,当反应重新达到平衡时,测得N2O4和HI的分解率分别为α/(A)和α/(B)。下列判断一定正确的是()
A. α(A)=α(B) B. α(A)>α/(A) C.α(B) =α/(B) D.α(A)= α/(A)
可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
有关该电池的说法正确的是()
| A.放电时负极附近溶液的碱性不变 |
| B.充电过程是化学能转化为电能的过程 |
| C.充电时阳极反应:Ni(OH)2-e— + OH--="=" NiOOH + H2O |
| D.放电时电解质溶液中的OH---向正极移动 |
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA |
| B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA |
| C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA |
| D.20 g重水(D2O)中含有的电子数为10NA |
向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是()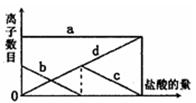
| A.a:Cl—; b:K+; c:CO32—; d:HCO3— |
| B.a:K+; b:CO32—; c:Cl—; d:HCO3— |
| C.a:K+; b:CO32—; c:HCO3—; d:Cl— |
| D.a:K+; b:HCO3—;c:Cl—; d: CO32— |