钴(Co)是一种重要的战略金属,钴及其合金广泛应用于电机、机械、化工、航空和航天等领域。钴在化合物中通常以+2、+3的形式存在。
(1)写出基态Co原子的核外电子排布式 ;
(2)Co2+、Co3+都能与CN—形成配位数为6的配离子。CN—中碳原子的杂化方式为 ;1mol HCN分子中σ键的数目为 。
(3)Co的一种氧化物的晶胞如图所示(其中黑球代表Co),则该氧化物的化学式为 在该晶体中与一个氧离子等距离且最近的Co离子所形成的空间构型为 。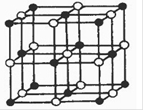
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4—,该配离子是一种相当强的还原剂,在加热时能与水反应生成[Co(CN)6]3—,写出该反应的离子方程式 。
反应 A+B→C(ΔH<0)分两步进行:①A+B→X (ΔH >0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是
反应A2+B2 2AB ΔH=QkJ/mol,在不同温度和压强改变的条件下,产物AB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
2AB ΔH=QkJ/mol,在不同温度和压强改变的条件下,产物AB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
| A.A2、B2及AB均为气体,Q>0 |
| B.AB为气体,A2、B2中有一种为非气体,Q>0 |
| C.AB为气体,A2、B2中有一种为非气体,Q<0 |
| D.AB为固体,A2、B2中有一种为非气体,Q>0 |
一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z (s),以下不能作为反应达到平衡标志的是
Y(g)+Z (s),以下不能作为反应达到平衡标志的是
| A.X的分解速率是Y的消耗速率 的2倍 |
| B.混合气体的压强不再变化 |
| C.混合气体的密度不再变化 |
| D.单位时间内生成lmolY的同时分解2mol X |
在恒温恒容的容器中进行下列反应:N2O4(g)  2NO2(g),若NO2的浓度由0.1mol/L增大到0.2mol/L时,需要5 s,那么NO2的浓度继续由0.2mol/L增大到0.4mol/L时,所需反应的时间为
2NO2(g),若NO2的浓度由0.1mol/L增大到0.2mol/L时,需要5 s,那么NO2的浓度继续由0.2mol/L增大到0.4mol/L时,所需反应的时间为
| A.小于10s | B.等于10s | C.大于10s | D.等于5s |
反应mA(s)+nB(g)  pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
①m+n>p ②y点表示的正反应速率小于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若降低温度,该反应的平衡常数增大
| A.①②⑤ | B.②④⑤ |
| C.只有①③ | D.①③⑤ |