在某一容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) 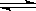 CO2(g)+H2(g);ΔH=a kJ/mol(a>0),反应达到平衡后,测得c(CO):c(CO2)=3:2。下列说法正确的是
CO2(g)+H2(g);ΔH=a kJ/mol(a>0),反应达到平衡后,测得c(CO):c(CO2)=3:2。下列说法正确的是
| A.反应放出的热量为0.2a kJ |
| B.平衡时H2O的转化率为40% |
| C.若升高温度,v(正)加快,v(逆)减慢,平衡正向移动 |
| D.若将容器的体积压缩为1L,有利于该反应平衡正向移动 |
下列说法不正确的是
| A.镀层破损后,镀镀锌铁板比锡铁板更耐腐蚀 |
| B.据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.等质量的硫固体和硫蒸气分别完全燃烧,后者放出的热量多 |
对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了适宜的催化剂
| A.②⑤ | B.①② | C.③⑤ | D.④⑥ |
用铁片与稀硫酸反应制取氢气时,下列措施可以使氢气生成速率加大的是
| A.加入少量的硫酸钠 | B.加入硝酸钠固体 |
| C.滴加少量CuSO4溶液 | D.改用浓硫酸 |
下列说法错误的是
| A.NH4NO3溶于水虽然吸热,但其溶于水是自发过程 |
| B.加热液体(温度高于沸点)会自发转变成气体,可用焓变解释 |
| C.对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值通常最小 |
| D.要正确判断化学反应能否自发进行,要综合考虑反应的ΔH和ΔS。 |
“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是
| A.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
| B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快 |
| C.对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子增多,反应速率加快 |
| D.活化分子之间的碰撞一定是有效碰撞 |