已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
| A.氢气的燃烧热为△H=-akJ·mol-1 |
| B.c<d |
| C.一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1 |
| D.0.5a>b |
下列离子方程式正确的是
| A.乙酸与碳酸钠溶液反应:2H++CO32—== CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O |
| C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O →2C6H5OH+CO32— |
D.甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH- CO32—+2NH4++4Ag↓+6NH3+2H2O CO32—+2NH4++4Ag↓+6NH3+2H2O |
具有显著抗癌活性的10-羟基喜树碱的结构如图所示。
下列关于10—羟基喜树碱的说法正确的是
| A.分子式为C20H16N2O5 |
| B.可用FeCl3溶液检验该物质是否发生水解 |
| C.该物质可与9mol H2发生加成反应 |
| D.一定条件下,1mol分别消耗Na、NaOH、Na2CO3的比值为2︰2︰1 |
对下图所示有机物分子的叙述错误的是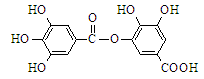
| A.能发生碱性水解,1 mol该有机物完全反应消耗8 mol NaOH |
| B.常温下,能与Na2CO3溶液反应放出CO2 |
| C.与稀硫酸共热,能生成两种有机物 |
| D.该有机物的分子式为C14H10O9 |
漆酚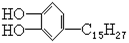 是我国特产漆的主要成分,漆酚不应具有的化学性质是
是我国特产漆的主要成分,漆酚不应具有的化学性质是
| A.可以跟FeCl3溶液发生显色反应 |
| B.可以使酸性KMnO4溶液褪色 |
| C.可以跟Na2CO3溶液反应放出CO2 |
| D.可以跟溴水发生取代和加成反应 |
白黎芦醇: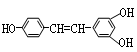 广泛存在于食物中,它可能具有抗癌性,能与1mol该化合物起反应的Br2或H2的最大用量分别为:
广泛存在于食物中,它可能具有抗癌性,能与1mol该化合物起反应的Br2或H2的最大用量分别为:
| A.1mol,7mol | B.3.5mol,7mol | C.3mol,6mol | D.6mol,7mol |