下列根据实验操作、实验现象所得出的结论不正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝 |
浓氨水显碱性 |
| B |
其他条件不变,压缩2HI(g)  I2(g)+H2(g)平衡体系的体积 I2(g)+H2(g)平衡体系的体积 |
混合气体颜色变深 |
平衡向生成I2(g)的方向移动 |
| C |
将碱式滴定管下部的胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠 |
使溶液从尖嘴流出 |
排出碱式滴定管尖嘴部分的气泡 |
| D |
向2.0mL浓度均为0.1mol/L的KCl、KI混合溶液中滴加1~2滴AgNO3溶液,振荡 |
沉淀呈黄色 |
Ksp(AgCl)>Ksp(AgI) |
NA表示表示阿伏伽德罗常数的值,下列说法正确的是
| A.1mol Na2O2粉末中含离子总数为4NA |
| B.22.4LCO2中含有的原子数为3NA |
| C.1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA |
| D.在一定量的稀硝酸中加入56g铁粉且完全溶解,转移的电子一定为3NA |
下列对应化学反应的离子方程式正确的是( )
| A.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+ |
| B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
| C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
2013年12月初,我国华北地区持续出现严重雾霾天气,严重影响人们的生活。为让生
态环境得到有效保护,下列做法均正确的是( )
①尽量减少化石燃料的使用;②全面关停化工企业;③研发易降解的生物农药;④改进汽车尾气净化技术
| A.①②③ | B.①③④ | C.①②④ | D.②③④ |
关于浓度相等的三种溶液:①H2CO3;②NaOH;③Na2CO3溶液,下列说法正确的是:
| A.水电离出的c(H+):③>①>② |
| B.溶液的pH:③>②>① |
| C.①和②等体积混合后的溶液:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) |
| D.①和③等体积混合后的溶液:c(Na+)+ c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
如图是元素周期表短周期元素的一部分。已知M最高价氧化物对应的水化物为常见的氧化性酸,下列说法正确的是: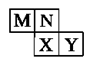
| A.M为氮元素 |
| B.原子半径:Y>X |
| C.氢化物沸点:X>N |
| D.M、X、Y三种元素的最高价氧化物对应的水化物均为强酸 |