下列实验操作与结论相符的是
| A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 |
| C.某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
| D.在蔗糖与稀硫酸共热后的溶液中加入新制Cu(OH)2,加热煮沸,会生成砖红色沉淀 |
由乙烯和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为()
| A.26.7% | B.15.6% | C.30% | D.无法确定 |
一定量的乙烷在氧气不足的情况下燃烧,得到CO、CO2和H2O的总质量为55.2g,若将产物通过浓H2SO4,浓H2SO4增重21.6g,则产物中CO的质量为
| A.2.8g | B.4. 4g | C.5.6g | D.8.8g |
以氯乙烷为原料制取乙二酸(HOOC-COOH)的过程中,要依次经过下列步骤中的:
①与NaOH的水溶液共热 ②与NaOH的醇溶液共热 ③与浓硫酸共热到170℃ ④在催化剂存在情况下与氯气加成 ⑤在Cu或Ag存在的情况下与氧气共热 ⑥与新制的Cu(OH)2共热
| A.①③④②⑥ | B.①③④②⑤ | C.②④①⑤⑥ | D.②④①⑥⑤ |
目前,世界上已合成了几百种有机超导体,TCNQ是其中之一。TCNQ的分子结构如下图所示。下列关于TCNQ说法错误的为 ()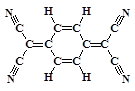
| A.分子中所有的氮原子在同一平面内 |
| B.属于芳香烃 |
| C.分子式为C12H4N4 |
| D.该物质难溶于水 |
橙花醇具玫瑰及苹果香气,可作香料,其结构简式如下,下列关于橙花醇的叙述,错误的是()
| A.既能发生取代反应,也能发生加成反应 |
| B.在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 |
| C.1mo1橙花醇在氧气中充分燃烧,需消耗470.4氧气(标准状况) |
| D.1mo1橙花醇在室温下与溴-四氯化碳溶液反应,最多消耗240g溴 |