有五个系列同族元素的物质,101.3 kPa时测定它们的沸点(℃)如下表所示:
| ① |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
| ② |
F2-187.0 |
Cl2-33.6 |
(b) 58.7 |
I2 184.0 |
| ③ |
(c) 19.4 |
HCl -84.0 |
HBr-67.0 |
HI -35.3 |
| ④ |
H2O 100.0 |
H2S -60.0 |
(d) -42.0 |
H2Te -1.8 |
| ⑤ |
CH4-161.0 |
SiH4-112.0 |
GeH4-90.0 |
(e)-52.0 |
对应表中内容,下列叙述中正确的是
A.系列①的(a)物质中没有离子键,应有共价键和分子间作用力
B.系列③中(c)物质的沸点比HCl高是因为(c)中的共价键更牢固
C.系列②中(b)物质的元素的原子序数应为35,且该物质常温下为液态
D.系列④中H2O沸点变化出现反常,是因为分子内有氢键的影响
下列说法错误的是()
| A.石油和天然气的主要成分都是碳氢化合物 |
| B.乙醇、乙酸和乙酸乙酯可以用饱和碳酸钠溶液鉴别 |
| C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D.甘氨酸(NH2-CH2-COOH)既能与NaOH反应,又能与盐酸反应 |
生活中常常碰到涉及化学知识的某些问题,下列叙述错误的是 ( )
| A.人的皮肤在强紫外线的照射下将会失去生理活性 |
| B.常用新制的氢氧化铜检验司机酒后驾车 |
| C.棉花和木材的主要成分都是纤维素 |
| D.蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水 |
下列各组物质中,只用溴水就能鉴别的一组是()
| A.己烯、苯、苯酚 | B.四氯化碳、硝基苯、乙醇 |
| C.乙酸、乙醇、苯酚 | D.乙烷、乙烯、乙炔 |
某有机物如右图,下列说法错误的是()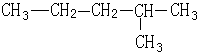
| A.该有机物属于饱和烷烃 |
| B.该有机物可由两种单炔烃分别与氢气加成得到 |
| C.该烃与2,3—二甲基丁烷互为同系物 |
| D.该烃的一氯取代产物共有5种 |
下列与有机物结构、性质相关的叙述正确的是()
| A.在水溶液里,乙酸分子中的—CH3可以电离出H+ |
| B.甲苯和乙苯可以用酸性高锰酸钾溶液鉴别 |
| C.甲烷和氯气反应生成一氯甲烷,与苯和氢气反应生成环己烷的反应类型相同 |
| D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |