下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是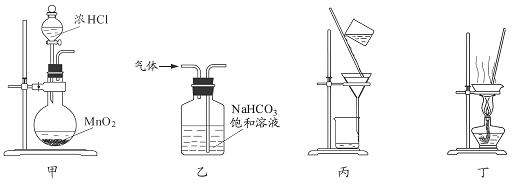
| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制 MnCl2·4H2O |
在标准状况下,将wg A气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为( )mol/L
A.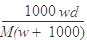 |
B.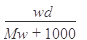 |
C.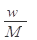 |
D.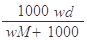 |
下列现象或应用中,不涉及胶体性质的是( )
| A.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 |
| B.清晨,在茂密的树林中,常可以看到从枝叶间透过的光柱 |
| C.用半透膜分离淀粉和食盐的混合液 |
| D.肾功能衰竭等疾病引起的血液中毒,可用血液透析进行治疗 |
NA代表阿伏加德罗常数,下列说法一定正确的是( )
| A.标准状况下,22.4LH2O所含原子个数为3NA |
| B.1.7g氨气所含原子数目为0.4NA |
| C.同温同压时,相同体积的任何气体单质所含的原子数相同 |
| D.1 L 1mol·L-1的Na2SO4溶液中含Na+的个数为NA |
在两个容积相同的容器中,一个盛有HCl气体,另一个盛满H2和Cl2的混合气体在同温同压下,两个容器内的气体一定具有相同的( )
| A.原子数 | B.密度 | C.质量 | D.摩尔质量 |
已知有反应2NO+O2=2NO2。今在体积为VL的密闭容器中通入 molNO和
molNO和 molO2。反应后容器中的氮原子和氧原子的原子个数之比是( )
molO2。反应后容器中的氮原子和氧原子的原子个数之比是( )
| A.a/b | B.a/2b | C.a/(a+2b) | D.a/(2a+2b) |