反应A(g)+B(g)→C(g) ΔH,分两步进行:①A(g)+B(g)→X(g) ΔH1,②X(g)→C(g) ΔH2,反应过程中能量变化如图所示, E1表示A(g)+B(g)→X(g)的活化能,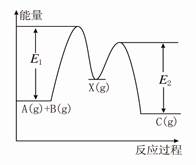
下列说法正确的是
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
对下列物质进行的分类正确的是
| A.纯碱、烧碱均属于碱 | B.CuSO4·5H2O属于纯净物 |
| C.凡能电离出H+的化合物均属于酸 | D.盐类物质一定含有金属阳离子 |
下列化学方程式中,不能用H++OH-=H2O表示的是
| A.2NaOH+H2SO4=Na2SO4+2H2O |
| B.Ba(OH)2+2HCl=BaCl2+2H2O |
| C.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O |
| D.KOH+HCl=KCl+H2O |
在溶液中能大量共存 ,加入OHˉ有沉淀析出,加入H+能放出气体的是
,加入OHˉ有沉淀析出,加入H+能放出气体的是
| A.Na+、HCO3-、Ca2+、Cl- | B.Ba2+、K+、OH-、NO3- |
| C.H+、Fe3+、NH4+、SO42- | D.Mg2+、Na+、Cl-、CO32- |
下列分离提纯的方法正确的是
| A.除去CO2中的HCl气体,通过盛足量饱和NaOH溶液的洗气瓶 |
| B.分离KNO3晶体中的少量NaCl,溶解后蒸发结晶、过滤 |
| C.用加热法分离氯化钠和碘的固体混合物 |
| D.除氢氧化钠溶液中的硫酸钠,加入适量氯化钡溶液后过滤 |
下列叙述中,正确的是
| A.失电子难的原子,获得电子的能力一定强 |
| B.得电子越多的氧化剂,其氧化性就越强 |
| C.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 |
| D.化学反应的实质是原子的重新组合 |