下列关于化学反应速率的说法中,正确的是
①用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 ②决定化学反应速率的主要因素是反应物的浓度. ③一定量的锌与过量的稀硫酸反应制取氢气,为减慢反应速率而又不影响生成H2的量,可向其中加入KNO3溶液。④汽车尾气中的NO和CO反应转化为无害的N2和CO2,减小压强,反应速率减慢 ⑤增大压强,一定能加快化学反应速率 ⑥用锌与稀硫酸反应制H2时,滴加几滴硫酸铜溶液能加快反应速率 ⑦使用催化剂,使反应的活化能降低,反应速率加快⑧光是影响某些化学反应速率的外界条件之一 ⑨反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在2 L的密闭容器中进行,1 min后,NH3减少了0.12 mol,则1 min末的化学反应速率为v(NO)=0.06 mol·L-1·min-1
4NO(g)+6H2O(g)在2 L的密闭容器中进行,1 min后,NH3减少了0.12 mol,则1 min末的化学反应速率为v(NO)=0.06 mol·L-1·min-1
| A.①⑤⑥⑨ | B.④⑥⑦⑧ | C.④⑥⑦⑨ | D.③④⑥⑦ |
已知A(g)+3B(g)=2C(g)+2D(g),若反应速率分别用ν(A)、ν(B)、ν(C)、ν(D)表示,下列反应速率中最快的是
A.ν(A)= 0.15mol·L-1·s-1
B.ν(B)= 0.60mol·L-1·s-1
C.ν(C)=" 0.40" mol·L-1·s-1
D.ν(D)= 0.45mol·L-1·s-1
下列有关金属防护的说法不正确的是
| A.通过镶嵌锌块保护船体的方法叫牺牲阳极的阴极保护法 |
| B.埋铁制管线时应选择致密、干燥的土壤层 |
| C.青铜器表面覆盖防渗高分子膜,可防止铜绿形成 |
| D.纯银器表面在空气中因电化学腐蚀渐渐变暗 |
用图所示装置除去含CN—、Cl—废水中的CN—时,控制溶液pH为9~10,阳极产生的ClO—将CN—氧化为两种无污染的气体,下列说法不正确的是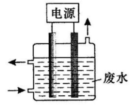
| A.用石墨作阳极,铁作阴极 |
| B.阳极的反应式为:Cl-+2OH- -2e-=ClO-+H2O |
| C.阴极的反应式为:2H2O+2e-=H2↑+2OH- |
| D.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示(质子交换膜只允许H+通过)。下列有关微生物电池的说法错误的是
| A.正极反应中有CO2生成 |
| B.微生物促进了反应中电子的转移 |
| C.质子通过交换膜从负极区移向正极区 |
| D.电池总反应为C6H12O6+6O2=6CO2+6H2O |
己知丙烷的燃烧热△H= -2215kJ·mol-1,若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为
| A.55 kJ | B.220kJ | C.550 kJ | D.1108 kJ |