I.A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8。请回答:
(1)试写出B2单质的电子式:________。试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式 。
(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液,其离子方程式是________________。
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,其化学反应方程式是________________。
(4)在2 L的密闭容器中,通入2 mol B2气体和3 mol A2气体,一定温度下反应生成BA3 气体,当反应达到平衡时,A2的浓度为0.15 mol·L-1,同时放出约83.2 kJ的热量,该反应的热化学方程式为_____________。
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式 ___________;若0.1 mol该化合物完全反应,转移电子的物质的量为________。
II.(1)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是________。
(2)若甲、乙分别是同一周期的ⅡA族和ⅦA族元素,原子序数分别为m和n,则m和n的关系为________。
Suzuki偶联反应在有机合成上有广泛应用。反应①如下(Ph-代表苯基 ─):
─):
反应①: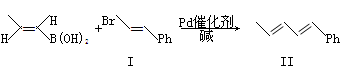
化合物I可以由以下途径合成:
(1)化合物V的分子式为;1mol化合物I最多可跟mol氢气反应。
(2)化合物IV的结构简式为;化合物V转化为化合物VI的反应类型为。
(3)写出化合物VI在NaOH溶液中共热的反应方程式。
(4)已知化合物Ⅶ是化合物V的同分异构体,其苯环上一溴代物有2种,且1mol Ⅶ与足量银氨溶液反应生成4mol Ag,写出化合物Ⅶ的一种结构简式。
(5)化合物(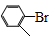 )与化合物【(HO)2B─
)与化合物【(HO)2B─ ─COOH】也能发生类似反应①的偶联反应,写出产物的结构简式。
─COOH】也能发生类似反应①的偶联反应,写出产物的结构简式。
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:
2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:
①从上表可以推断:该反应的逆反应是(填“吸”、“放”)热反应。
②此温度下该反应的平衡常数表达式为K=__________________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________。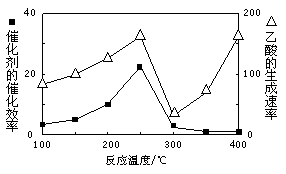
②为了提高该反应中CH4的转化率,可以采取的措施是。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为。
(3)Li2O、Na2O、MgO均能吸收CO2。
①如果寻找吸收CO2的其他物质,下列建议合理的是________。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是___________________________。
呋喃酚是合成农药的重要中间体,其合成路线如下: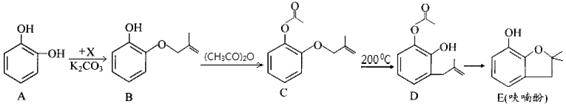
(1)A物质核磁共振氢谱共有个峰,B→C的反应类型是;E中含有的官能团名称是。
(2)已知x的分子式为C4H7C1,写出A→B的化学方程式:。
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y的名称(系统命名)是。
(4)下列有关化合物C、D的说法正确的是。
①可用氯化铁溶液鉴别C和D ②C和D含有的官能团完全相同
③C和D互为同分异构体 ④C和D均能使溴水褪色
(5)E的同分异构体很多,写出符合下列条件的芳香族同分异构体的结构简式:。
①环上的一氯代物只有一种②含有酯基③能发生银镜反应
I.一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。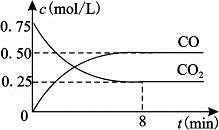
(1)8分钟内,CO的平均反应速率v(CO)=___________(结果保留3位有效数字)。
(2)1100℃时该反应的平衡常数K=(填数值);该温度下,若在8分钟时CO2和CO各增加0.5mol/L,此时平衡移动(填“正向”、“逆向”或“不”)。
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
3molFe、2molCO2 |
4molFeO、3molCO |
| CO的浓度(mol/L) |
C1 |
C2 |
| CO2的体积分数 |
φ1 |
φ2 |
| 体系压强(Pa) |
P1 |
P2 |
下列说法正确的是___________(填序号);
A.2C1 = 3C2 B.φ1 = φ2 C.P1<P2
II.(4)已知:①Fe(OH)3(aq) Fe3+(aq)+3OH-(aq);ΔH=" a" kJ•mol-1
Fe3+(aq)+3OH-(aq);ΔH=" a" kJ•mol-1
②H2O(l) H+(aq)+OH-(aq);ΔH="b" kJ•mol-1
H+(aq)+OH-(aq);ΔH="b" kJ•mol-1
请写出Fe3+发生水解反应的热化学方程式:。
(5)柠檬酸(用H3R表示)可用作酸洗剂,除去水垢中的氧化铁。
溶液中H3R、H2R-、HR2--、R3-的微粒数百分含量与pH的关系如图所示。图中a曲线所代表的微粒数的百分含量随溶液pH的改变而变化的原因是(结合必要的方程式解释)。调节柠檬酸溶液的pH=4时,溶液中上述4种微粒含量最多的是(填微粒符号)。
III.(6)高铁酸钠(Na2FeO4)广泛应用于净水、电池工业等领域,工业常用电解法制备,其原理为
Fe+2OH--+2H2O FeO42--+3H2↑
FeO42--+3H2↑
请设计一个电解池并在答题卡的方框内画出该装置的示意图并作相应标注。
其阳极反应式为:________________________________。
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成: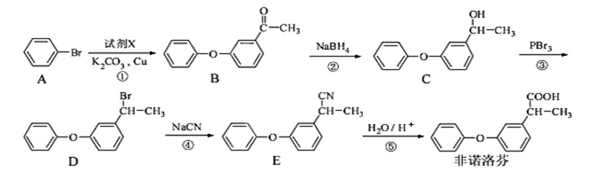
(1)非诺洛芬中的含氧官能团为和(填名称)。
(2)在上述五步反应中,属于取代反应的是(填序号)。
(3)若过程①生成的另一种产物有HBr,写出由A到B发生反应的化学方程式。
(4)非诺洛芬的一种同分异构体满足下列条件:
I.分子中含有两个苯环
II.能与NaHCO3反应放出CO2,能与 FeCl3溶液发生显色反应。
III.分子中有6 种不同化学环境的氢,且各种氢原子个数比为6:2:2:2:1:1。
写出符合条件的一种同分异构体的结构简式:。
(5)下面为以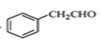 为原料制备
为原料制备 的部分合成路线流程图。
的部分合成路线流程图。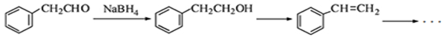
①写出由 的反应方程式;
的反应方程式;
②根据已有知识并结合相关信息把合成路线流程图补充完整(无机试剂任选,在箭头上写出参与反应的物质及反应条件) 。
。