I.氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
(1)反应开始时反应速率加快的原因是___________________。
(2)反应后期反应速率下降的原因是___________________。
II.用惰性电极电解200 mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。
(1)下列说法正确的是______(填序号)。
| A.电解过程中,b电极表面先有红色物质析出,后有气泡产生 |
| B.a电极上发生的反应为2H++2e-===H2↑和4OH--4e-===2H2O+O2↑ |
| C.从P点到Q点时收集到的混合气体的平均摩尔质量为12 g·mol-1 |
| D.OP段表示H2和O2混合气体的体积变化,PQ段表示O2的体积变化 |
(2)如果要使溶液恢复到电解前的状态,向溶液中加入0.8 g CuO即可,则电解后溶液的c(H+)= ______。(3)如果向所得的溶液中加入0.1 mol Cu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为______mol。
(4)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为______mol。
(5分)麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗中感觉不到疼痛。
(1)一种常用的麻醉剂氯仿(CHCl3),常因保存不善被氧化而变质,产生剧毒物光气(COCl2)。
2CHCl3+O2 2HCl+2COCl2.为防止发生事故,使用前可用于检验是否变质的试剂是(填序号)________。
2HCl+2COCl2.为防止发生事故,使用前可用于检验是否变质的试剂是(填序号)________。
| A.淀粉碘化钾溶液 | B.NaOH溶液 |
| C.酚酞溶液 | D.硝酸酸化的硝酸银溶液 |
(2)稀有气体氙气(Xe)在医疗上很受重视,常常作为麻醉剂,氙气能溶于细胞的油脂里,引起细胞麻醉和膨胀,从而神经末梢作用暂时停止。人们曾试用体积分数为80%氙气和20%的氧气组成的混合气体,作为无副作用的麻醉剂。氙在元素周期表中位于_______周期,______族,它的原子序数是______。
(3)作为稀有气体,氙的化学性质不活泼,但它可在一定条件下生成化合物。取1molXe和3.5mol氟气于一密闭容器内充分反应,后来余下了1.5mol的氟气同时有白色固体生成,此白色固体的化学式为_________。
(7分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。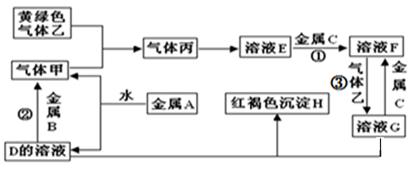
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A__________;H ___________; G__________;乙_________;
(2)写出下列反应的化学方程式
反应①________________
反应②________________
反应③_________________
氨气是一种重要的化工产品,工业上可以按照下图所示流程生产氨气: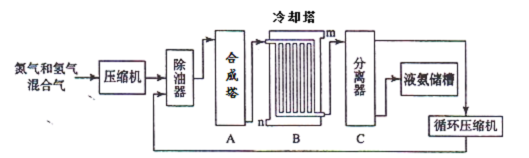
(1)原料气之一氮气的工业制取方法是 ,写出氨气的工业用途(任答一点) 。
(2)写出合成塔中发生的反应的化学反应方程式 。在冷却塔中对混合气体进行冷却,冷水的入口 (答m或n)。
(3)设备C的作用 。其分离器中的过程对整个工业合成氨的意义 (试结合平衡移动原理回答)。
(4)在原料气制备过程中混有 CO对催化剂有毒害作用,欲除去原料气中的 CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于 (精确到小数点后一位)。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于 (精确到小数点后一位)。
煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出。目前我国采用的控制方法是电厂烟气脱硫。烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
I、钠碱循环法脱硫技术。
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式: 。
(2)NaOH溶液吸收SO的过程中,pH随 变化关系如下表:
变化关系如下表:
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母): 。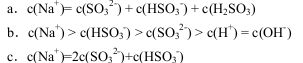
II、石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4 (s)+ CO (g) CaO(s)+ SO2 (g)+ CO2 (g) △H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+ SO2 (g)+ CO2 (g) △H=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) △H2= -175.6kJ·mol-1 (反应Ⅱ)
CaS(s)+ 4CO2(g) △H2= -175.6kJ·mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s)的热化学反应方程式 。
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp= (用表达式表示)。
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。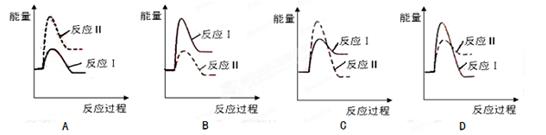
(4)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数 的关系曲线。则降低该反应体系中产生的SO2生成量的措施有 。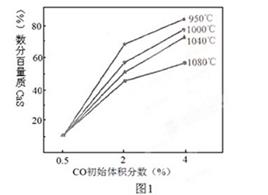
A、向该反应体系中投入生石灰
B、在合适的温度区间内控制较低的反应温度
C、降低CO的初始体积百分数
D、提高反应体系的温度
下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题: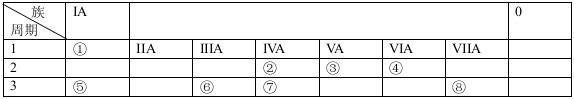
(1)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)____________ ____。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)_______。
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式:_______________。
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:_______。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
(6)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式: 。