下列化学用语表示正确的是
| A.氯化钙的化学式 CaCl |
B.HCl分子的电子式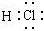 |
C.氯化钠的电子式 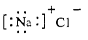 |
D.氯原子的结构示意图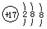 |
下列比较、归纳一定正确的是
| A.酸性:HClO4>H2CO3>H2SiO3 |
| B.稳定性:HF<H2O<NH3 |
| C.离子半径:Na+>F-> Al3+ |
| D.沸点:HI>HBr>HF |
NA代表阿伏加德罗常数的值,下列说法正确的是
| A.Na2O2与水反应制O2,每生成0.25molO2转移电子数为1NA |
| B.等物质的量的N2和CO所含原子数均为2NA |
| C.在标准状况下,11.2L HCHO所含的分子数约为0.5NA |
| D.1molSO2与足量的O2反应,转移的电子数为2NA |
利用下列实验装置完成相应的实验,能完全达到实验目的的是
下图是化学能与电能相互转化的两套装置。下列分析正确的是
| A.两装置中,铁电极均要消耗 |
| B.图2装置中两极均有气泡产生 |
| C.图1装置铁电极上发生的电极反应为:Fe-3e-===Fe3+ |
| D.随着反应的进行,图1装置中溶液的pH增大,图2装置中溶液的pH不变 |
在一定条件下,RO3-与R-发生如下反应:RO3-+5R-+6H+===3R2+3H2O,下列关于R元素及单质的叙述,正确的是
| A.R可能位于VA族 |
| B.R的氢化物的水溶液一定属于强酸 |
| C.RO3-中的R只能被还原 |
| D.R的氢化物的水溶液可能显碱性 |