下列叙述I和II均正确且有因果关系的是
| 选项 |
叙述I |
叙述II |
| A |
SO2具有漂白性 |
SO2可使溴水褪色 |
| B |
非金属性:F>Cl |
酸性:HF>HCl |
| C |
Si是半导体 |
Si用于制造光导纤维 |
| D |
35Cl和37Cl互为同位素 |
35Cl和37Cl化学性质几乎相同 |
下列有关焰色反应的实验操作注意事项的说明,其中正确的是( )
①钾的焰色要透过蓝色钴玻璃观察②先将铂丝灼烧到与原火焰颜色相同,再蘸取被检物质③每次实验完,均要用盐酸洗净铂丝④实验时,要尽可能选用本身颜色较浅的火焰
| A.只有① | B.只有③ |
| C.①②③ | D.全部 |
向含有下列各组离子的溶液中滴加NaOH溶液,得到白色沉淀的是( )
| A.Ba2+ HCO- 3K+ Cl- |
B.Na+ CO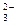 OH- NO OH- NO |
C.Na+ OH- SO CO CO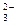 |
| D.Mg2+ NO- 3Na+ Cl- |
下列离子方程式不正确的是( )
| A.碳酸钠溶液和盐酸反应 Na2CO3+2H+  2Na++CO2↑+H2O 2Na++CO2↑+H2O |
| B.过氧化钠和水反应 2Na2O2+2H2O  4Na++4OH-+O2↑ 4Na++4OH-+O2↑ |
| C.钠跟水反应 Na+H2O  Na++OH-+H2↑ Na++OH-+H2↑ |
| D.碳酸氢钠溶液跟稀硝酸反应 |
HCO +H+
+H+ CO2↑+H2O
CO2↑+H2O
下列灭火剂能用于扑灭金属钠着火的是( )
| A.干冰灭火剂 |
| B.黄沙 |
| C.干粉(含NaHCO3)灭火剂 |
| D.泡沫灭火剂 |
下列关于Na和Na+性质的叙述正确的是( )
| A.它们都具有强还原性 |
| B.它们的电子层数相同 |
| C.它们都显碱性 |
| D.它们被灼烧时的火焰都呈现黄色 |