市场上常用的一种锂离子电池的电池反应式为:LiC6+2Li0.35NiO2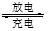 2Li0.85NiO2+C6,下列说法中不正确的是
2Li0.85NiO2+C6,下列说法中不正确的是
| A.该电池不能用水溶液作为电解质 |
| B.放电时,Li+向负极移动 |
| C.充电时,电极Li0.85NiO2质量会减小 |
| D.放电时,负极的反应为:LiC6-e-=Li++C6 |
反应:2H2(g)+O2(g)=2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是()
| A.△H1<0 | B.△H2为该反应的反应热 |
| C.△H3不是H2的燃烧热 | D.△H3=△H1+△H2 |
下列说法中正确的是()
| A.在Na3PO4溶液中,c(Na+)是c(PO43-)的3倍 |
| B.pH=3的盐酸中,其c(H+)是pH=1的盐酸中的c(H+)的3倍 |
| C.0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)相等 |
| D.在25℃时,无论酸性、中性还是碱性溶液中,其c(H+)和c(OH-)的乘积都等于1×10-14 |
常温下,0.1mol/L的下列溶液中,水的电离程度大小排列顺序正确的是()
①AlCl3②KNO3③NaOH④NH3·H2O
| A.①>②>③>④ | B.①>②>④>③ | C.③>④>②>① | D.①=②=③=④ |
下列各物质的颜色变化不是由平衡移动引起的是()
| A.H2、I2、HI平衡混合气体加压颜色变深 |
| B.氯水光照颜色变浅 |
| C.NO2、N2O4混合气体加热颜色变深 |
| D.FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
| A.曲线Ⅰ:滴加溶液到10 mL时: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| C.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-) |