运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义(1)硫酸生产中,SO2催化氧化生成SO3; 2SO2(g)+O2(g) 2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题:
2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题: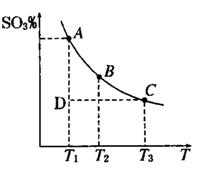
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填 “>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H 0(填 “>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”)
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 K2;温度为T1时,反应进行到状态D时,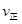
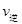 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
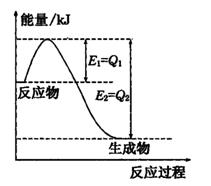
①如图是一定的温度和压强下N2(g)和H2(g)反应生成lmol NH3(g)过程中能量变化示意图,图中E1、E2分别表示的意义是____________、____________
②请写出工业合成氨的热化学方程式: (△H的数值用含字母Q1、Q2的代数式表示)
下表是元素周期表的一部分,回答下列有关问题(用化学符号回答):
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
||
| 4 |
⑩ |
(1)在①~⑩元素中,最活泼的金属元素是,最活泼的非金属元素是,最不活泼的元素是。
(2)在①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是,碱性最强的是,呈两性的是。写出在水溶液中三者之间相互反应的离子方程式:,
,
。
用铜、银与硝酸银设计一个原电池,此电池的负极是:,
负极的电极反应式是:,
总反应方程式为。
在水溶液中,YO3-与S2-发生反应的离子方程式:YO3-+3S2-+6H+=Y-+3S↓+3H2O。请回答:
(1)YO3—中Y的化合价是_______。
(2)Y元素原子的最外层电子数是_______,它可能处于第_______族。
下图是元素周期表的前四周期的结构,请回答
| A |
|||||||||||||||||
| B |
C |
D |
|||||||||||||||
| E |
F |
G |
|||||||||||||||
| H |
|||||||||||||||||
⑴请写出各元素的元素符号:A、B、C、D、
⑵请写出C元素单质的结构式
⑶E、D两种元素可形成一种原子个数比为1:1的化合物M,请写出M的电子式,指出化合物M中的化学键类型。
⑷E、F、G三种元素的最高价氧化物对应的水化物可以两两反应,请写出反应的离子方程式:
E+F
E+G
F+G
⑸H的一种氢氧化物不稳定,很容易被氧气氧化,请写出该反应的化学方程式:
⑴一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。若反应物的总能量(填“>”、“<”、“=”)生成物的总能量,该反应就放出能量;若反应物的总能量生成物的总能量,该反应就吸收能量。
⑵普通锌锰酸性干电池的内部结构如图所示,请回答
①该电池的负极材料为该电极反应为
②正极材料为,正极得到电子的氧化剂为
③电解质为
⑶化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示。若时间用秒表示,则化学反应速率的单位是。
⑷在外界条件不变的情况下,一个可逆反应达到的最大限度是该反应达到状态。