向5 mL 0.1 mol·L-1的KI溶液中滴加5~6滴0.1 mol·L-1的FeCl3溶液后,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是
| A.再滴加AgNO3溶液,观察是否有AgI沉淀产生 |
| B.加入CCl4振荡后,观察下层液体颜色 |
| C.再滴加AgNO3溶液,观察是否有AgCl沉淀产生 |
| D.再滴加KSCN溶液,观察是否有血红色 |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( )
| A.在熔融电解质中,O2-由负极移向正极 |
| B.通入丁烷的一极是正极,电极反应为:2C4H10+26e-+13O2-=4CO2+5H2O |
| C.通入空气的一极是负极,电极反应为:O2+4e-=2O2- |
D.电池的总反应是:2C4H10+13O2® 8 CO2+10H2O CO2+10H2O |
用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间 后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为()
后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为()
| A.0.5mol·L-1 | B.0.8mol·L-1 | C.1.0mol·L-1 | D.1.5mol·L-1 |
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是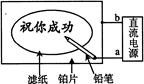
A铅笔端作阳极,发生还原反应
B、铂片端作阴极,发生氧化反应
C铅笔端有少量的氯气产生
D a点是负极,b点是正极
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )
| A.CuCl2 [CuSO4] | B.NaOH [NaOH] | C.NaCl [HCl] | D.CuSO4 [Cu(OH)2] |
银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是()
| A.锌为正极,Ag2O为负极; | B.锌 为阳极,Ag2O为阴极; 为阳极,Ag2O为阴极; |
| C.原电池工作时,负极区PH减小; | D.原电池工作时,负极区PH增大; |