(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 |
实验目的 |
T/℃ |
NO初始浓度 mol/L |
CO初始浓度 mol/L |
同种催化剂的比表面积m2/g |
| Ⅰ |
为以下实验作参照 |
280 |
6.50×10-3 |
4.00×10-3 |
80 |
| Ⅱ |
|
|
|
|
120 |
| Ⅲ |
探究温度对尾气转化速率的影响 |
360 |
6.50×10-3 |
4.00×10-3 |
80 |
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________(填“增大”、“减小”、“无影响”)。
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·s-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
(9分)掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
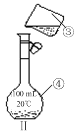
⑴写出下列仪器的名称:①;②;④;
⑵仪器①~④中,使用时必须检查是否漏水的有(填序号)。
⑶若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有,将仪器补充完整后进行的实验操作的名称为;实验时仪器②中冷却水的进口为_________(选填“f”或“g”)。
⑷现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的错误有。
某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答: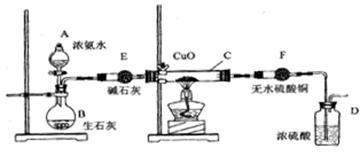
(1)写出用熟石灰和氯化铵反应制氨气的化学方程式
(2) 本实验进行一断时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式:,这个反应说明氨气具有____(填编号:A、碱性;B、还原性;C、氧化性; D、不稳定性)
(3) 洗气瓶中盛浓硫酸的主要作用是__________________
(4) 在最后的出气的导管口收集干燥、纯净的氮气,收集方法是:___________
(填编号:A、排气法 B、排水法 C、用气囊收集)
(5)装置E的作用是_______________。装置F验证的气体是___________。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液由;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察;
(3)该小组在步骤①中的错误是,由此造成的测定结果___________ (填偏高、偏低或无影响)
(4)步骤②缺少的操作是_______ ____
(5)右图,是某次滴定时的滴定管中的液面,其读数为___________mL;(上面数字:22,下面数字:23)。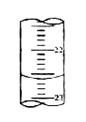
某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗.为使液体顺利流下,还需插入“空气导入管”与大气相通.(空气导入管没有液体流出的可能)
(1)“空气导入管”下口应在A,上口应在C
| A.滤纸边沿下方 | B.滤纸边沿上方 |
| C.待过滤液液面上 | D.待过滤液中 |
E.A和B项均可 F.C和D项均可
(2)试简要说明自动加液过滤的原理.
试回答下列中学化学实验室中的有关问题:
(1)下列仪器中:①分液漏斗;②试剂瓶;③集气瓶;④滴瓶;⑤托盘天平;⑥容量瓶;⑦量筒;标有使用温度的仪器有。
(2)在仪器①漏斗;②容量瓶;③蒸馏烧瓶;④分液漏斗;⑤烧杯;⑥蒸发皿中,可用于粗盐提纯实验的有;可用于分离两种沸点接近且互不相溶的液态混合物实验的有。
(3)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在仪器①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶中,用到“磨砂”的有。
(4)在一次实验中,学生需要使用1.0mol·L-1的NaOH溶液460mL,在实验室配制溶液时回答如下问题:
①使用托盘天平称取NaOH固体g。
②误差分析:用字母填写A.偏大 B.偏小 C.无影响
Ⅰ.溶解后溶液未冷却至室温,就转移到容量瓶中,立即定容。则浓度。
Ⅱ.定容时俯视液面,则浓度。